ENZYMATIC REACTION KINETICS
pag-aaral ng mga pattern ng daloy sa oras ng enzymatic p-tions, pati na rin ang kanilang mekanismo; kabanata kinetika ng kemikal.
catalytic ang cycle ng conversion sa-va S (substrate) sa produktong P sa ilalim ng pagkilos ng enzyme E ay nagpapatuloy sa pagbuo ng isang intermediate. conn. X i:
saan ki- rate constants ng mga indibidwal na antas ng elementarya,
pagbuo ng enzyme-substrate complex X 1 (ES, Michaelis complex).
Sa isang naibigay na t-re, ang rate ng p-tion ay nakasalalay sa mga konsentrasyon ng enzyme, substrate, at ang komposisyon ng medium. Mayroong nakatigil, pre-stationary at relaxation kinetics ng enzymatic p-tions.
Nakatigil na kinetics. Sa isang nakatigil na estado sa intermediate Comm. (dX i/dt= 0, i = 1, ..., n) at may labis na substrate , kung saan ang [S] 0 at [E] 0 ay ang mga paunang konsentrasyon, ayon sa pagkakabanggit. substrate at enzyme, ang kinetics ng proseso ay nailalarawan sa pamamagitan ng isang pare-pareho, time-invariant na antas ng mga konsentrasyon sa pagitan. comp., at ang expression para sa rate ng proseso v 0, tinawag paunang nakatigil na bilis, ay may anyo (Michaelis-Menten equation):
 (1)
(1)
kung saan ang mga halaga k pusa at K m -> mga function ng rate constants ng elementary stages at ibinibigay ng mga equation:

Ang halaga ng k pusa
tinawag mahusay na catalytic. rate ng proseso pare-pareho, parameter K m -> Michaelis pare-pareho. Ang halaga ng k pusa
tinutukoy ng mga dami max. mabagal na yugto catalytic. mga distrito at kung minsan ay tinatawag. ang bilang ng mga rebolusyon ng enzyme (enzyme system); k pusa
nagpapakilala sa bilang ng catalytic. mga siklo na ginagawa ng sistema ng enzyme bawat yunit ng oras. Naib. karaniwan, may halaga ng k pusa. para sa tiyak. mga substrate sa hanay ng 10 2 -10 3 s -1 . Ang mga karaniwang halaga ng patuloy na Michaelis ay nasa hanay na 10 -3 - 10 -4 M.
Sa mataas na konsentrasyon ng substrate, kapag iyon ay, ang rate ng p-tion ay hindi nakasalalay sa konsentrasyon ng substrate at umabot sa isang palaging halaga, na tinatawag. Max. bilis. Sa graphically, ang Michaelis-Menten equation ay isang hyperbole. Maaari itong i-linearize gamit ang paraan ng double reciprocals (ang Lineweaver-Burk method), ibig sabihin, pagbuo ng dependence ng 1/v sa 1/[S] 0 , o iba pang pamamaraan. Ang linear na anyo ng equation (1) ay may anyo:
 (2)
(2)
Binibigyang-daan ka nitong matukoy nang graphical ang mga halaga K m at v max (Larawan 1).

kanin. 1. Graph ng linear transformation ng Michaelis - Menten equation sa double reciprocals (ayon kay Lineweaver - Burke).
Halaga K m > numerical na katumbas ng konsentrasyon ng substrate, kung saan ang rate ng p-tion ay pantay, samakatuwid K m madalas nagsisilbing sukatan ng pagkakaugnay ng substrate at ng enzyme, ngunit ito ay totoo lamang kung
Dami K m > at nagbabago depende sa mga halaga ng pH. Ito ay dahil sa kakayahan ng mga grupo ng molekula ng enzyme na kasangkot sa catalysis na baguhin ang kanilang estado ng ionization at, sa gayon, ang kanilang catalytic. kahusayan. Sa pinakasimpleng kaso, ang pagbabago sa pH ay humahantong sa protonation o deprotonation ng hindi bababa sa dalawang ionizable na grupo ng enzyme na kasangkot sa catalysis. Kung sa kasong ito, isang anyo lamang ng enzyme-substrate complex (halimbawa, ESH) sa tatlong posibleng (ES, ESH at ESH 2) ang maaaring maging isang produkto ng solusyon, kung gayon ang pagdepende ng rate sa pH ay inilarawan. sa pamamagitan ng f-loy:

saan f= 1 + / at f" = 1 +
+K" b/>-T. tinawag pH-function ng Michaelis, at K a, K b at K" a, K" b -> group ionization constants a at b, ayon sa pagkakabanggit. libre enzyme at enzyme-substrate complex. Sa lg coordinates - pH ang pag-asa na ito ay ipinapakita sa fig. 2, at ang mga tangent ng mga slope ng mga tangent sa pataas, pH-independent, at pababang mga sanga ng curve ay dapat na +1, 0, at -1, ayon sa pagkakabanggit. Mula sa gayong graph, matutukoy ng isa ang mga halaga RK a mga pangkat na kasangkot sa catalysis.

kanin. 2. Pag-asa ng catalytic mga constant mula pH hanggang logarithmic. mga coordinate.
Ang rate ng enzymatic p-tion ay hindi palaging napapailalim sa equation (1). Isa sa mga pinaka-karaniwang kaso - pakikilahok sa distrito ng allosteric. mga enzyme (tingnan mga regulator ng enzyme) para sa to-rykh ang pag-asa ng antas ng saturation ng enzyme sa [S] 0 ay hindi hyperbolic. karakter (Larawan 3). Ang phenomenon na ito ay dahil sa cooperativity ng substrate binding, ibig sabihin, kapag ang pagbubuklod ng isang substrate sa isa sa mga site ng enzyme macromolecule ay tumataas (positive cooperativity) o bumababa (negative cooperativity) affinity para sa substrate ng isa pang site.

kanin. H Ang pag-asa ng antas ng saturation ng enzyme na may substrate sa konsentrasyon ng substrate na may positibong (I) at negatibong (II) na kooperatiba, pati na rin sa kawalan nito (III).
Prestationary kinetics. Sa mabilis na paghahalo ng mga solusyon ng enzyme at substrate sa pagitan ng oras na 10 -6 -10 -1 s, maaaring maobserbahan ang mga lumilipas na proseso na nauuna sa pagbuo ng isang matatag na nakatigil na estado. Sa pre-stationary mode na ito, kapag gumagamit ng malaking labis ng substrate, ang differential system. Ang ur-tion, na naglalarawan sa mga kinetika ng mga proseso, ay linear. Ang solusyon ng ganitong uri ng sistema ng mga linear na kaugalian. Ang ur-tion ay ibinibigay ng kabuuan ng mga exponential terms. Kaya, para sa kinetic scheme na ipinakita sa itaas, ang kinetics ng akumulasyon ng produkto ay may anyo:

kung saan ang A ako ->, b at n -> mga function ng elementary rate constants; -ugat ng kaukulang katangian. ur-tion.
Ang kapalit ng , tinatawag na. katangian oras ng proseso:
Para sa p-tion, umaagos na may partisipasyon ng nintermediate. Comm., maaari kang makakuha ng characteristic. beses.
Ang pag-aaral ng kinetics ng enzymatic district sa pre-stationary mode ay nagbibigay-daan sa iyo upang makakuha ng ideya ng detalyadong mekanismo ng catalytic. cycle at tukuyin ang rate constants ng elementarya yugto ng proseso.
Sa eksperimento, ang kinetics ng enzymatic solution sa pre-stationary mode ay pinag-aralan gamit ang stop jet method (tingnan ang Fig. jet kinetic na pamamaraan), na nagpapahintulot na paghaluin ang mga bahagi ng distrito sa loob ng 1 ms.
Relaxation kinetics. Sa mabilis na nakakabagabag na epekto sa system (mga pagbabago sa t-ry, pressure, electric field), ang oras na aabutin ng system upang makamit ang isang bagong equilibrium o nakatigil na estado ay nakasalalay sa bilis ng mga proseso na tumutukoy sa catalytic. enzymatic cycle.
Ang sistema ng mga equation na naglalarawan sa mga kinetika ng proseso ay linear kung ang displacement mula sa posisyon ng equilibrium ay maliit. Ang solusyon ng system ay humahantong sa mga dependency ng mga konsentrasyon ng mga sangkap na nabubulok. mga yugto ng proseso sa anyo ng isang kabuuan ng mga exponential terms, ang mga exponent nito ay may katangian ng mga oras ng pagpapahinga. Ang resulta ng pag-aaral ay ang spectrum ng mga oras ng pagpapahinga na tumutugma sa bilang ng mga agwat. Kasama sa proseso ang Comm. Ang mga oras ng pagpapahinga ay nakasalalay sa mga pare-pareho ng rate ng elementarya na mga yugto ng mga proseso.
Mga paraan ng pagpapahinga Ginagawang posible ng kinetics na matukoy ang mga constant ng rate ng mga indibidwal na elementarya na yugto ng pagbabagong-anyo ng mga intermediate. Ang mga pamamaraan para sa pag-aaral ng relaxation kinetics ay iba. resolution: ultrasound absorption - 10 -6 -10 -10
s, temperatura jump - 1O -4 -10 -6 s, electric na paraan. salpok - 10 -4 -10 -6 s, pressure jump - 10 -2 s. Sa pag-aaral ng kinetics ng enzymatic p-tions, ang application ay natagpuan sa pamamagitan ng paraan ng temperatura jump.
Macrokinetics ng mga proseso ng enzymatic. Pag-unlad ng mga pamamaraan para sa pagkuha ng mga heterogenous catalysts sa pamamagitan ng immobilization ng enzymes sa decomp. media (tingnan Hindi kumikilos na mga enzyme) kinakailangan ang pagsusuri ng mga kinetika ng mga proseso na isinasaalang-alang ang paglipat ng masa ng substrate. Ang mga regularidad ng kinetics ng mga p-tion ay pinag-aralan sa teorya at eksperimental, na isinasaalang-alang ang mga epekto ng diffusion layer at para sa mga system na may kahirapan sa intradiffusion sa pamamahagi ng enzyme sa loob ng carrier.
Sa ilalim ng mga kondisyon kung saan ang kinetics ng proseso ay apektado ng diffusion transfer ng substrate, catalytic. bumababa ang kahusayan ng system. Ang kadahilanan ng kahusayan ay katumbas ng ratio ng density ng daloy ng produkto sa ilalim ng mga kondisyon ng daloy ng distrito ng enzymatic na may isang diffusion-reduced na konsentrasyon ng substrate sa daloy, na maaaring maisakatuparan sa kawalan ng mga paghihigpit sa pagsasabog. Sa purong rehiyon ng diffusion, kapag ang rate ng proseso ay tinutukoy ng mass transfer ng substrate, ang efficiency factor para sa mga system na may external diffusion inhibition ay inversely proportional sa diffusion modulus:

saan
kapal ng pagsasabog ng layer, D - koepisyent. pagsasabog ng substrate.
Para sa mga system na may intradiffusion deceleration sa first-order p-tions

saan f T- walang sukat na module (Thiele module).
Kapag sinusuri ang kinetic regularities sa fermentation reactors malawak na teoretikal. at eksperimento. Ang mga "ideal" na modelo ng mga reactor, isang flow reactor (isang flow reactor ng perpektong paghahalo), isang flow reactor na may perpektong displacement, at isang membrane reactor, ay binuo.
Kinetics ng mga proseso ng polyenzymatic. Sa katawan (cell), ang mga enzyme ay hindi kumikilos sa paghihiwalay, ngunit catalyze ang mga kadena ng pagbabagong-anyo ng mga molekula. R-tion sa polyenzymatic system na may kinetic. ang mga punto ng view ay makikita bilang pare-pareho. mga proseso, tiyak Ang isang tampok ng to-rykh ay ang mga enzyme ng bawat isa sa mga yugto:
saan ,
resp. max, bilis ng proseso at Michaelis constant i ika-stage ng distrito, ayon sa pagkakabanggit.
Ang isang mahalagang tampok ng proseso ay ang posibilidad ng pagbuo ng isang matatag na nakatigil na estado. Ang kondisyon para sa paglitaw nito ay maaaring ang hindi pagkakapantay-pantay > v 0 , kung saan ang v 0 ay ang rate ng yugto ng paglilimita, na nailalarawan ng pinakamaliit na rate constant at sa gayon ay tinutukoy ang rate ng buong sequence. proseso. Sa nakatigil na estado, ang konsentrasyon ng mga metabolite pagkatapos ng yugto ng paglilimita ay mas mababa kaysa sa Michaelis constant ng kaukulang enzyme.
Tukoy ang isang pangkat ng mga polyenzymatic system ay binubuo ng mga system na nagsasagawa ng oxidizing.-restore. p-tion kasama ang pakikilahok ng mga carrier ng protina ng elektron. Ang mga carrier ay tiyak na bumubuo. mga istruktura, mga complex na may deterministikong pagkakasunud-sunod ng paglilipat ng elektron. Kinetic ang paglalarawan ng naturang mga sistema ay itinuturing na isang independiyenteng variable ng estado ng mga circuit na may decomp. antas ng populasyon ng mga electron.
Aplikasyon. F. r. malawakang ginagamit sa pagsasanay sa pananaliksik upang pag-aralan ang mga mekanismo ng pagkilos ng mga enzyme at mga sistema ng enzyme. Ang praktikal na makabuluhang lugar ng agham ng enzyme ay enzymology ng engineering, gumagana sa mga konsepto ng F. r. para sa pag-optimize ng biotechnol. mga proseso.
Lit.: Poltorak O. M., Chukhrai E. S., Pisikal at kemikal na mga base ng enzymatic catalysis, M., 1971; Berezin IV, Martinek K, Mga Batayan ng pisikal na kimika ng enzymatic catalysis, M., 1977; Varfolomeev S. D., Zaitsev S. V., Kinetic na pamamaraan sa biochemical research, M .. 1982. S. D. Varfolomeev.
Ensiklopedya ng kemikal. - M.: Soviet Encyclopedia. Ed. I. L. Knunyants. 1988 .
Tingnan kung ano ang "ENZYMATIVE REACTION KINETICS" sa ibang mga diksyunaryo:
catalytic paikot. isang proseso na binubuo ng isang bilang ng mga elementarya na rasyon, ang mga bilis nito ay inilalarawan ng kumikilos na batas ng masa. Ang batas na ito ay may simpleng anyo para sa mga perpektong pinaghalong gas, perpektong p moat, at perpektong mga layer sa ibabaw. ... ... Chemical Encyclopedia
Mga kinetika ng mga reaksiyong kemikal, ang doktrina ng mga proseso ng kemikal, ang mga batas ng kanilang daloy sa oras, bilis at mekanismo. Ang pinakamahalagang bahagi ng modernong kimika at kemikal ... ... ay nauugnay sa pag-aaral ng kinetika ng mga reaksiyong kemikal. Great Soviet Encyclopedia
KINETICS CHEMICAL- (mula sa Griyego. kinesis movement), isang departamento ng teoretikal na kimika na nakatuon sa pag-aaral ng mga batas ng kimika. mga reaksyon. Mayroong ilang mga uri ng chem. pakikipag-ugnayan at, higit sa lahat, upang makilala ang mga reaksyong nagaganap sa isang homogenous (homogenous) medium mula sa mga reaksyon na ... ... Malaking Medical Encyclopedia
- (biocatalysis), acceleration ng biochemical. rasyon na may partisipasyon ng mga macromolecule ng protina na tinatawag na enzymes (enzymes). F. to. isang uri ng catalysis, kahit na ang terminong fermentation (fermentation) ay kilala mula pa noong sinaunang panahon, noong walang konsepto ng kemikal. catalysis. Una…… Chemical Encyclopedia
- (mula sa Latin na re prefix, na nangangahulugang baligtad na pagkilos, at pagkilos ng pagkilos), ang pagbabago ng ilan sa in (mga paunang tambalan) sa iba (mga produkto ng reaksyon) na may invariability ng nuclei ng mga atomo (hindi katulad ng mga reaksyong nuklear). Mga paunang koneksyon sa R. x. minsan tinatawag na ...... Chemical Encyclopedia
- (mula sa lat. fermentum lebadura) (enzymes), mga protina na kumikilos bilang mga catalyst sa mga buhay na organismo. Pangunahin function ng F. upang mapabilis ang pagbabagong-anyo sa, pagpasok sa katawan at nabuo sa panahon ng metabolismo (upang i-renew ang mga istruktura ng cellular, upang matiyak ito ... Chemical Encyclopedia
- (mula sa Greek pharmakon medicine at kinetikos setting in motion), nag-aaral ng kinetic. mga pattern ng mga prosesong nagaganap sa lek. cfd sa katawan. Pangunahin pharmacokinetic. mga proseso: absorption, distribution, metabolism at excretion (excretion). ... ... Chemical Encyclopedia
Sa t=36-38 0 ang mga enzyme ay may pinakamataas na aktibidad. Ang temperaturang ito ay tinatawag na pinakamainam na temperatura:
Sa pagtaas ng t 0 sa pinakamabuting kalagayan, ang aktibidad ng mga enzyme ay tumataas.
Ang mataas na t ay nagdudulot ng denaturation ng enzyme.
Ang mababang t ay binabawasan ang aktibidad ng mga enzyme.
Ang pagbabago sa t 0 ay humahantong sa pagkagambala ng mga bono na nag-aayos ng istruktura ng protina ng mga enzyme (tertiary, quaternary), i.e. nagiging sanhi ng denaturation.
Ang nababaligtad na denaturation ay sinusunod sa pagbaba ng t 0 . Pinapayagan ka nitong mag-imbak ng mga enzyme, likido sa katawan, dugo.
Ang pagtaas ng temperatura ay hindi maibabalik na nakakagambala sa istruktura ng protina ng enzyme. Ang ari-arian na ito ay ginagamit sa isterilisasyon ng mga materyales at instrumento.
Ang lagnat ay isang proteksiyon na ari-arian ng katawan, dahil. mayroong isang denaturation ng mga enzyme ng mga microorganism at samakatuwid ay hindi naaangkop na gumamit ng antipyretics.
Ang pag-asa ng rate ng reaksyon sa pH
Sa graph, ang pag-asa na ito ay mukhang isang kampana. Sa tuktok ng curve mayroong isang pH optimum point kung saan ang enzyme ang may pinakamataas na aktibidad. Nakakaapekto ang pH sa antas ng ionization ng acidic at basic na mga grupo. Sa iba't ibang mga halaga ng pH, ang aktibong sentro ay maaaring nasa isang bahagyang ionized o hindi-ionized na anyo, na nakakaapekto sa tertiary na istraktura ng aktibong sentro at ang pagbuo ng enzyme-substrate complex.
Epekto ng pH.
Ang mga enzyme, tulad ng lahat ng protina, ay naglalaman ng maraming positibo at negatibong nahawaang grupo (-NH 2 , -COOH), na bahagi ng mga amino acid na arg, lys, asp, at glu. Ang kabuuang singil ay depende sa ratio sa pagitan ng mga pangkat na ito. Ang singil ng protina-enzyme ay nagbabago depende sa konsentrasyon ng mga hydrogen ions sa cell, na neutralisahin (sugpuin ang dissociation) ng carboxyl group:
at bumuo ng mga pangkat na may positibong charge:
Kaya, ang pagtaas ng positibong singil o pagbaba ng negatibong singil sa ibabaw ng enzyme ay dahil sa pagtaas ng konsentrasyon ng mga hydrogen ions.
Ang estado ng isang molekula ng protina kung saan ang kabuuang singil ng protina ay 0 ay tinatawag na isoelectric na estado.
Ang halaga ng pH kung saan ang singil ng isang molekula ng protina ay 0 ay tinatawag na isoelectric point (IEP).
Karamihan sa mga enzyme ay pinaka-aktibo at matatag sa paligid ng isoelectric point.
Ang matalim na pagbabagu-bago sa pH ay nagtataguyod ng denaturation ng protina, i.e. pagbaba sa aktibidad ng enzymatic.
Ang pH value kung saan ang enzyme ay nagpapakita ng pinakamataas na aktibidad ay tinatawag na pH optimum, na katangian ng isang ibinigay na enzyme na tumutugon sa isang partikular na substrate.
Ang mga intracellular enzyme ay karaniwang may pinakamainam na pH na tumutugma sa isang neutral na kapaligiran (pH = 7) na malapit sa normal na halaga ng pH para sa mga likido sa katawan. May mga enzyme na ang pinakamainam na pH ay nasa isang malakas na acidic at malakas na alkaline na kapaligiran.
Pag-uuri ng mga enzyme.
Mayroong anim na klase ng mga enzyme:
1. Hydrolases - mga enzyme na sumisira sa substrate na may partisipasyon ng mga molekula ng tubig.
2. Lyases - mga enzyme na sumisira sa mga molekula ng substrate nang walang paglahok ng tubig, habang ang mga produktong mababang molekular na timbang ay madalas na nabuo - CO 2, NH 3, H 2 O.
3. Isomerases - mga enzyme na nagdudulot ng isomeric transformations sa molekula.
4. Ferases (transferases) - mga enzyme na naglilipat ng mga grupo mula sa isang molekula patungo sa isa pa o mula sa isang posisyon patungo sa isa pa sa loob ng isang molekula.
5. Oxidoreductases - mga enzyme na nagpapagana sa paglipat ng mga proton at electron (i.e. redox reactions).
6. Ligases (synthetases) - mga enzyme na nagpapagana ng synthesis ng malalaking molekula mula sa mas maliliit.
Enzyme nomenclature.
Ang gumaganang pangalan ng isang enzyme ay binubuo ng pangalan ng substrate, ang uri ng reaksyon na catalyzed, at ang nagtatapos na -aza.
Ang sistematikong pangalan ay binubuo ng pangalan ng mga substrate, ang pangalan ng uri ng pagbabagong kemikal na na-catalyzed, at ang nagtatapos na -aza.
Ang pangalan ng klase ay nagpapahiwatig ng uri ng kemikal na reaksyon na na-catalyze ng mga enzyme. Ang mga klase ay nahahati sa mga subclass - tinutukoy ang pagkilos ng enzyme, dahil ipinapahiwatig nito ang likas na katangian ng grupo ng kemikal ng substrate na inaatake ng enzyme. Ang subclass ay nahahati sa mga subclass. Tinukoy ng mga subsubclass ang pagkilos ng enzyme, na tinutukoy ang likas na katangian ng inatake na substrate bond o ang likas na katangian ng acceptor.
I. Ang mga oxidoreductases ay nagpapanggitna ng mga reaksiyong redox. Ang mga oxidoreductases ay tinatawag ding dehydrogenases o reductases. Ang mga oxidoreductases ay nagdadala ng mga proton at electron. Ang mga oxidoreductases ay nahahati sa mga subclass:
1. Aerobic dehydrogenases - ilipat ang mga proton at electron sa oxygen.
Ang mga coenzyme ng oxidoreductases ay:
NAD - nicotinamide adenine dinucleotide - naglalaman ng bitamina B 5 - nicotinamide.
NADP - nicotinamide adenine dinucleotide phosphate, naglalaman ng bitamina B 5.
FAD - flavin adenine dinucleotide, naglalaman ng bitamina B 2 - riboflavin.
FMN - flavin mononucleotide, naglalaman ng bitamina B 2 - riboflavin.
Ang mga oxidoreductases ay nag-catalyze ng mga reaksyon ng dehydrogenation, i.e. pag-aalis ng hydrogen.
Ang mga oxidoreductases ay nag-oxidize sa mga sumusunod na functional na grupo:
OH, -C \u003d O, -NH 2
Ang mga dehydrogenase coenzymes ay nakakabit ng mga proton at electron.
Ang mga dehydrogenases na umaasa sa NAD ay nag-oxidize sa mga sumusunod na functional na grupo: alcohol hydroxyl (OH), aldehyde group (COH), amino group (NH 2).
Ang mga dehydrogenases na umaasa sa NAD ay nagpapanggitna sa mga sumusunod na uri ng mga reaksyon:
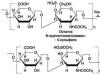
1. Dehydrogenation ng hydroxyl group
| lactate dehydrogenase |
COOH OVER + NADH + H + CH 3
lactate pyruvate
lactic acid
2. Dehydrogenation ng aldehyde group (dehydrogenation ng glyceraldehyde - 3 - phosphate)
| + OVER + + H 3 RO 4 | + NADH + H +
CH 2 OPO 3 H 2 CH 2 OPO 3 H 2
Glyceraldehyde-3-phosphate 1,3-biphosphoglyceric acid
3. Dehydrogenation ng mga amino group
UNSD UNSD
CH 2 + HIGIT SA CH 2
| | + NADH + H +
CH 2 glutamate dehydrogenase CH 2
Glutamic acid
FAD - dependent dehydrogenases oxidize (dehydrogenate) ang mga sumusunod na functional na grupo: ang pag-aalis ng hydrogen mula sa mga grupo -CH 2 - CH 2 - na may pagbuo ng isang double bond.
UNSD UNSD
| FADH FADH 2 |
CH 2 succinate dehydrogenase CH
UNSD UNSD
Succinate fumarate
2. Ang anaerobic dehydrogenases ay naglilipat ng mga proton at electron hindi sa oxygen, ngunit sa ibang substrate. Ang mga enzyme na ito ay tinatawag ding oxygenases.
II. Ang mga transferase ay mga enzyme na nagpapagana sa paglipat ng iba't ibang grupo mula sa isang substrate patungo sa isa pa.
Mga subclass ng Transferase:
1. Isinasagawa ng mga aminotransferases ang paglipat ng isang amino group mula sa isang amino acid patungo sa isang keto acid. Catalyze ang transamination reaksyon.
2. Ang mga methyltransferases ay nag-catalyze sa paglipat ng mga methyl group (CH 3 -).
3. Ang mga phosphotransferases ay pinapagana ang paglipat ng isang residue ng phosphoric acid. Ang isang subclass ng phosphotransferases ay kinabibilangan ng mga kinase na gumagamit ng ATP bilang isang phosphate residue donor.
III. Ang mga lyases ay mga enzyme na nagpapagana sa pagkalagot ng C-O, C-C, C-N at iba pang mga bono, pati na rin ang nababaligtad na mga reaksyon ng cleavage ng iba't ibang grupo, nang walang paglahok ng tubig.
1. Carboxylase - pagdaragdag ng isang carboxyl group (CO 2).
2. Dehydratase - ang pag-alis ng isang molekula ng tubig mula sa substrate.
3. Aldolases - hatiin ang C-C bond.
4. Hydratases - mga enzyme ng tubig sa isang double bond.
IV. Ang isomerases ay mga enzyme na nagpapagana ng pagbabago sa loob ng isang molekula.
Catalyze ang mga reaksyon ng isomerization. Mga subclass: mutases, tautomerases, racemases, epimerases, isomerases.
V. Ang mga hydralases ay mga enzyme na nagpapagana sa pagkasira ng mga bono sa pagkakaroon ng tubig.
VI. Ang mga ligase (synthetases) ay mga enzyme na nagpapagana sa pagsasama ng dalawang molekula gamit ang enerhiya ng ATP phosphate bond.
Impluwensya ng mababang molekular na sangkap sa aktibidad ng mga enzyme.
Ang mga mababang molekular na timbang na sangkap na nagbabago sa rate ng mga reaksyon ng enzymatic ay nahahati sa 2 grupo:
1. Activators - nagpapabilis sa kurso ng isang enzymatic reaction.
2. Inhibitors - nagpapabagal sa kurso ng mga reaksyong enzymatic.
Ang mga activator ay nahahati sa 2 pangkat:
1. Maaaring kumilos bilang isang activator coenzymes o prosthetic group(pangunahin ang mga bitamina).
Ang pangkat na ito ay nailalarawan sa pamamagitan ng parehong mga pattern na inilarawan para sa pakikipag-ugnayan ng enzyme at ang substrate na F+S at A+Ko ay sumusunod sa parehong mga pattern
Tinutukoy ng K m kung magkano ang ipasok sa Ko.
2. Mga activator na isang link sa pagitan ng F at S (orientation ng enzyme at substrate) at tinitiyak ang interaksyon ng enzyme at substrate (F A S), ang interaksyon ng apoenzyme at ang cofactor na Apof A Ko
Kadalasan ang mga ito ay Me-Co, Mn, Mg, Zn ions.
Kahalagahan ng pagsugpo sa aktibidad ng enzyme.
1. Pinagbabatayan ng pagsugpo ang pagkilos ng mga gamot at nakakalason na ahente.
2. Ang pagsugpo ay isa sa mga diskarte sa pag-aaral ng enzymatic action (halimbawa, ang istraktura ng aktibong sentro).
Ang pagsugpo ay may 2 uri:
1. Hindi maibabalik
2. Nababaligtad
Ang hindi maibabalik na pagsugpo ay nangyayari kapag ang pagbubuklod ng inhibitor sa enzyme ay hindi maibabalik.
Halimbawa: ito ang aksyon ng mga alkylating agent (podacetamide) na hindi maibabalik na kumikilos sa thio group ng mga enzyme. Ang irreversibility ay dahil sa ang katunayan na ang equilibrium ay inilipat sa kanan, patungo sa pagbuo ng isang covalent derivative ng enzyme:
F-S-H + J-CH 2 CONH 2 F-S-CH 2 -CONH 2 + HJ
Ang hindi maibabalik ay ang pagkilos ng mga nakakalason na organophosphorus compound, na tinatawag na nerve poisons, pinipigilan nila ang acetylcholinesterase na kasangkot sa paghahatid ng mga nerve impulses.
hindi maibabalik na pagsugpo
Maraming mga inhibitor ang hindi maibabalik sa E o ES, at dahil nakakaapekto ito sa V max , ang pagsugpo na ito ay itinuturing na hindi mapagkumpitensya.
Ang mga inhibitor ng ganitong uri ay madalas na nagbubuklod ng covalently sa enzyme o sa enzyme-substrate complex, na hindi maibabalik sa pagbabago ng katutubong pagsasaayos. Ipinapaliwanag nito ang nakakalason na epekto ng Hg 2+, Pb 2+ at arsenic compound.
Ang pagkilos ng penicillin ay batay sa hindi maibabalik na pagsugpo. Pinipigilan ng penicillin ang pagkilos ng isa sa mga enzyme na kasangkot sa pag-assemble ng bacterial cell wall. Ang mga cell na walang cell wall ay madaling lysed.
Ang pagkilos ng aspirin ay batay sa covalent modification ng enzyme. Binabawasan ng aspirin ang rate ng synthesis ng prostaglandin, na kumikilos bilang isang inhibitor ng cyclooxygenase na bahagi ng endoperoxide synthetase. Ito ay pinaniniwalaan na ang paglitaw ng sakit, pamamaga, temperatura ay nauugnay sa mga prostaglandin.
Sa kaso ng pagkalasing, ang pagbubuklod ng lason o ang pag-alis nito mula sa enzyme-inhibitor complex ay posible sa tulong ng mga reactivator, o antidotes. Kabilang dito ang lahat ng complexone na naglalaman ng SH (cysteine, dimercaptopropanol), citric acid.
Ang nababaligtad na pagsugpo ay may 2 uri:
1. Mapagkumpitensya
2. Non-competitive
Reversible competitive inhibition - ang aktibidad ng enzyme ay naibalik pagkatapos ng pagtanggal ng inhibitor sa pamamagitan ng pagtaas ng konsentrasyon ng substrate.
Ang isang natatanging katangian ng isang mapagkumpitensyang inhibitor ay ang mapagkumpitensyang inhibitor ay katulad ng istraktura sa substrate. Ang isang mapagkumpitensyang inhibitor ay nakikipagkumpitensya sa substrate para sa aktibong site ng enzyme.
Halimbawa: ang succinate dehydrogenase ay nag-catalyses ng conversion ng succinate sa fumarate. Ang isang mapagkumpitensyang inhibitor ng succinate dehydrogenase ay malonic acid, na naglalaman ng isang CH2 group na mas mababa sa succinate.
COOH COOH COOH
CH 2 CH CH 2
CH 2 CH COOH
| | malonic acid
UNSD UNSD
Ang succinate at malonic acid ay mga structural analogs at nakikipagkumpitensya para sa aktibong site ng enzyme. (Ito ay isang kumpirmasyon na ang aktibong site ay hindi isang matibay na pormasyon, na angkop para sa substrate, tulad ng isang "key-lock".)
Sa mapagkumpitensyang pagsugpo, ang antas ng pagsugpo sa enzyme ay hindi nakasalalay sa ganap na konsentrasyon ng inhibitor, ngunit sa ratio ng inhibitor at substrate, kung ang ratio na ito ay J: S=1:50, kung gayon ang aktibidad ng enzyme ay hinahadlangan ng 50%.
Ang pagkilos ng isang mapagkumpitensyang inhibitor ay tinanggal sa pamamagitan ng pagtaas ng konsentrasyon ng substrate, dahil ang affinity ng enzyme at ang substrate ay mas mataas kaysa sa affinity ng enzyme at ang inhibitor.
Ang Km F at S at Km F at J ay magkaiba at ito ay kilala sa pamamagitan ng paglalagay ng Michaelis-Menten at Lineever-Burk
Vmax - pareho
Tumataas ang K m kasama ng inhibitor.
Ang pagkilos ng maraming mga ahente ng chemotherapeutic ay batay sa mapagkumpitensyang pagsugpo. Halimbawa, ang mga paghahanda ng sulfanilamide na ginagamit upang gamutin ang mga sakit na dulot ng mga impeksiyong microbial. Ang mga paghahanda ng sulfanilamide ay structurally katulad ng p-aminobenzoic acid. Ang PABA ay isang precursor sa microbiological synthesis ng folic acid, kung saan ang coenzyme ay kinakailangan para sa synthesis ng nucleic acid ng mga microorganism. Sa pagpapakilala ng mga paghahanda ng sulfanilamide, ang pagsugpo sa enzyme at pagkamatay ng mga microorganism ay sinusunod.
Ang paggamit ng fluorouracil, na ginagamit sa paggamot ng kanser, ay batay din sa mapagkumpitensyang pagsugpo.
Noncompetitive, nababaligtad na pagsugpo.
Ang pagkilos ng isang non-competitive inhibitor ay hindi maaaring alisin sa pamamagitan ng pagtaas ng konsentrasyon ng substrate.
Non-competitive inhibitor hindi binds sa aktibong site, maaari itong magbigkis sa libreng enzyme, o sa FS complex, o pareho, ngunit ang parehong mga anyo ng JF at JFS ay hindi aktibo.
K m - ay hindi nagbabago, dahil walang aktibong site na nagbubuklod.
Vmax - bumababa.
Ang pinakakaraniwang uri ng hindi mapagkumpitensyang pagsugpo ay nangyayari sa ilalim ng pagkilos ng mga reagents na reversibly na nagbubuklod sa mga SH-group ng cis na matatagpuan sa catalytic center o malapit dito. Ang mga ito ay Cu 2+, Hg 2+, Ag + ions at ang kanilang mga derivatives sa pagbuo ng mercaptides:
Ang mga enzyme na nangangailangan ng Me ion para sa pag-activate ay hinahadlangan sa ganitong paraan ng mga ahente na nagbubuklod sa mga ion na ito:
ferro o ferrocyanide.
Regulasyon ng aktibidad ng enzyme.
Ang paggamit ng mga enzyme sa parmasya, gamot.
Mga uri ng regulasyon ng aktibidad ng enzyme:
1. Allosteric na pagbabago.
2. Pag-activate ng zymogens.
3. Regulasyon sa pamamagitan ng kemikal na pagbabago.
Pagtatapos ng trabaho -
Ang paksang ito ay kabilang sa:
Istraktura, katangian at pag-andar ng mga protina
Ang pagpapaliwanag ng istraktura ng mga protina ay isa sa mga pangunahing problema ng modernong biochemistry .. Ang mga molekula ng protina ay mga high-molecular compound .. Karamihan sa mga protina ay may antas ng organisasyon ng istraktura ng molekula ng protina ..
Kung kailangan mo ng karagdagang materyal sa paksang ito, o hindi mo nakita ang iyong hinahanap, inirerekumenda namin ang paggamit ng paghahanap sa aming database ng mga gawa:
Ano ang gagawin natin sa natanggap na materyal:
Kung ang materyal na ito ay naging kapaki-pakinabang para sa iyo, maaari mo itong i-save sa iyong pahina sa mga social network:
TRABAHO NG KURSO
Kinetics ng mga reaksyong enzymatic
Panimula
Ang batayan ng buhay ng anumang organismo ay mga proseso ng kemikal. Halos lahat ng mga reaksyon sa isang buhay na organismo ay nagpapatuloy sa pakikilahok ng mga natural na biocatalyst - mga enzyme.
Si Berzelius noong 1835 sa unang pagkakataon ay iminungkahi na ang mga reaksyon ng isang buhay na organismo ay isinasagawa dahil sa isang bagong puwersa, na tinawag niyang "catalytic". Pinatunayan niya ang ideyang ito pangunahin sa pamamagitan ng isang eksperimentong obserbasyon: ang diastase mula sa patatas ay nag-hydrolyse ng starch nang mas mabilis kaysa sa sulfuric acid. Noon pang 1878, tinawag ni Kuhne ang isang sangkap na may catalytic power sa isang buhay na organismo bilang isang enzyme.
Ang kinetics ng pagkilos ng enzyme ay isang sangay ng pag-aaral ng enzymatic na pinag-aaralan ang pag-asa ng rate ng isang reaksyon na na-catalyze ng mga enzyme sa likas na kemikal at mga kondisyon ng pakikipag-ugnayan ng substrate sa enzyme, pati na rin sa mga kadahilanan sa kapaligiran. Sa madaling salita, ginagawang posible ng kinetics ng mga enzyme na maunawaan ang likas na katangian ng mga mekanismo ng molekular ng pagkilos ng mga kadahilanan na nakakaapekto sa rate ng enzymatic catalysis. Ang seksyong ito ay nabuo sa intersection ng mga agham gaya ng biochemistry, physics at matematika. Ang pinakamaagang pagtatangka na mathematically ilarawan ang mga enzymatic na reaksyon ay ginawa ni Duclos noong 1898.
Sa katunayan, ang seksyong ito sa pag-aaral ng mga enzyme ay napakahalaga sa ating panahon, lalo na para sa praktikal na gamot. Nagbibigay ito sa mga pharmacologist ng isang tool upang baguhin ang metabolismo ng cell, isang malaking bilang ng mga parmasyutiko at iba't ibang mga lason - ito ay mga inhibitor ng enzyme.
Ang layunin ng gawaing ito ay isaalang-alang ang tanong ng pag-asa ng rate ng reaksyon sa iba't ibang mga kadahilanan, kung paano makokontrol ang rate ng reaksyon at kung paano ito matutukoy.
1. Michaelis-Menten kinetics
Ang mga paunang eksperimento sa pag-aaral ng kinetics ng mga reaksyon ng enzymatic ay nagpakita na ang rate ng reaksyon, salungat sa mga inaasahan ng teoretikal, ay hindi nakasalalay sa konsentrasyon ng enzyme (E) at substrate (S) sa parehong paraan tulad ng sa kaso ng isang maginoo. pangalawang-order na reaksyon.
Brown at, nang nakapag-iisa sa kanya, si Henri ang unang naglagay ng hypothesis tungkol sa pagbuo ng isang enzyme-substrate complex sa panahon ng reaksyon. Pagkatapos ang pagpapalagay na ito ay nakumpirma ng tatlong pang-eksperimentong katotohanan:
a) ang papain ay bumuo ng isang hindi matutunaw na tambalan na may fibrin (Wurtz, 1880);
b) ang invertase substrate sucrose ay maaaring maprotektahan ang enzyme mula sa thermal denaturation (O'Sullivan at Thompson, 1890);
c) ang mga enzyme ay ipinakita na stereochemically specific catalysts (Fischer, 1898-1899).
![]()
Ipinakilala nila ang konsepto ng maximum na bilis at ipinakita iyon saturation curve(ibig sabihin, ang pag-asa ng rate ng reaksyon sa konsentrasyon ng substrate) ay isang isosceles hyperbola. Pinatunayan nila na ang pinakamataas na naobserbahang bilis ay isa sa mga asymptotes sa curve, at ang segment ay pinutol sa x-axis (sa rehiyon ng mga negatibong halaga nito) ng pangalawang asymptote, i.e. pare-pareho sa rate equation, katumbas ng absolute value sa substrate na konsentrasyon na kinakailangan upang makamit ang kalahati ng maximum na rate.
Iminungkahi nina Michaelis at Menten na ang rate ng reaksyon ay tinutukoy ng pagkasira ng ES complex, i.e. pare-pareho k 2 . Ito ay posible lamang sa ilalim ng kondisyon na k 2 ay ang pinakamaliit sa rate constants. Sa kasong ito, ang equilibrium sa pagitan ng enzyme-substrate complex, ang libreng enzyme at ang substrate ay mabilis na naitatag kumpara sa rate ng reaksyon (mabilis na equilibrium).
Ang paunang rate ng reaksyon ay maaaring ipahayag sa pamamagitan ng sumusunod na pormula:
v = k2
Dahil ang dissociation constant ng enzyme-substrate complex ay
K S \u003d [E] [S] / \u003d k -1 / k 1
kung gayon ang konsentrasyon ng libreng enzyme ay maaaring ipahayag bilang
[E]=K S / [S]
Ang kabuuang konsentrasyon ng enzyme sa pinaghalong reaksyon ay tinutukoy ng formula
[E] t = [E] + [ES] = K S [ES] / [S] + [ES]
Ang reaksyon ay umabot sa pinakamataas na rate nito kapag ang konsentrasyon ng substrate ay sapat na mataas upang ang lahat ng mga molekula ng enzyme ay nasa anyo ng isang ES complex (isang walang katapusang malaking labis ng substrate). Ang ratio ng paunang bilis sa theoretically posibleng maximum na bilis ay katumbas ng ratio ng [ES] sa [E] t:
v / V max = / [E] t = / (K S / [S] + ) = 1 / (K S + [S] +1)

Ito ang klasikong equation Michaelis at Menten, na, mula nang mailathala ito noong 1913, ay naging pangunahing prinsipyo ng lahat ng enzyme kinetic na pag-aaral sa loob ng mga dekada at, na may ilang mga limitasyon, ay nanatili hanggang ngayon.
Sa kalaunan ay ipinakita na ang orihinal na Michaelis-Menten equation ay may ilang mga hadlang. Ito ay patas, i.e. wastong naglalarawan ng kinetics ng reaksyon na na-catalyze ng enzyme na ito kung ang lahat ng sumusunod na mga paghihigpit na kondisyon ay natutugunan:
) isang kinetically stable enzyme-substrate complex ay nabuo;
) pare-pareho ang K S ay ang dissociation constant ng enzyme-substrate complex: ito ay totoo lamang kung ;
) ang konsentrasyon ng substrate ay hindi nagbabago sa panahon ng reaksyon, i.e. ang konsentrasyon ng libreng substrate ay katumbas ng paunang konsentrasyon nito;
) ang produkto ng reaksyon ay mabilis na natanggal mula sa enzyme, i.e. walang kinetically makabuluhang halaga ng ES complex ay nabuo;
) ang ikalawang yugto ng reaksyon ay hindi maibabalik; mas tiyak, isinasaalang-alang lamang namin ang paunang bilis, kapag ang reaksyon sa likod (dahil sa aktwal na kakulangan ng produkto) ay maaari pa ring mapabayaan;
) isang molekula ng substrate lamang ang nagbubuklod sa bawat aktibong site ng enzyme;
) para sa lahat ng mga reactant, ang kanilang mga konsentrasyon ay maaaring gamitin sa halip na mga aktibidad.
Ang Michaelis-Menten equation ay nagsisilbing panimulang punto para sa anumang quantitative na paglalarawan ng pagkilos ng mga enzyme. Dapat itong bigyang-diin na ang kinetic na pag-uugali ng karamihan sa mga enzyme ay mas kumplikado kaysa sa sumusunod mula sa idealized na pamamaraan na pinagbabatayan ng Michaelis-Menten equation. Sa pagkuha ng equation na ito, ipinapalagay na mayroon lamang isang enzyme-substrate complex. Samantala, sa katotohanan, sa karamihan ng mga reaksyon ng enzymatic, hindi bababa sa dalawa o tatlong tulad ng mga complex ang nabuo, na nagmumula sa isang tiyak na pagkakasunud-sunod.
Dito, tinutukoy ng EZ ang kumplikadong naaayon sa totoong estado ng paglipat, at ang EP ay tumutukoy sa kumplikado sa pagitan ng enzyme at produkto ng reaksyon. Maaari din itong ituro na sa karamihan ng mga reaksyong enzymatic higit sa isang substrate ang kasangkot at dalawa o higit pang mga produkto ang nabuo, ayon sa pagkakabanggit. Sa isang reaksyon na may dalawang substrate, S 1 at S 2 , tatlong enzyme-substrate complex ang maaaring mabuo, katulad ng ES 1 , ES 2 at ES 1 S 2 . Kung ang reaksyon ay gumagawa ng dalawang produkto, P 1 at P 2 , maaaring mayroong hindi bababa sa tatlong karagdagang mga complex EP 1 , EP 2 at EP 1 P 2 . Sa ganitong mga reaksyon, mayroong maraming mga intermediate na hakbang, na ang bawat isa ay nailalarawan sa pamamagitan ng sarili nitong rate constant. Ang kinetic analysis ng mga reaksyong enzymatic na kinasasangkutan ng dalawa o higit pang mga reactant ay kadalasang lubhang kumplikado at nangangailangan ng paggamit ng mga elektronikong kompyuter. Gayunpaman, kapag sinusuri ang kinetics ng lahat ng mga reaksyong enzymatic, ang panimulang punto ay palaging ang Michaelis-Menten equation na tinalakay sa itaas.
1.1 Ang katangian ng pare-parehoKsa equation
equation enzymatic reaction kinetics
Ang pangalawang postulate ay nagsasaad na ang pare-parehong K S sa equation ay ang dissociation constant ng enzyme-substrate complex.
Pinatunayan nina Briggs at Haldane noong 1925 na ang orihinal na Michaelis-Menten equation ay balido lamang para sa , i.e. kapag ang ekwilibriyo ng elementarya na yugto E+S ES ay naitatag nang napakabilis kumpara sa rate ng susunod na yugto. Samakatuwid, ang gayong mga mekanismo ng kinetiko (pagsunod sa paunang kondisyon ng Michaelis-Menten at pagkakaroon ng isang mabagal na yugto ng elementarya, kung saan ang equilibria sa lahat ng iba pang mga elementarya ay mabilis na naitatag) ay tinatawag na nagbibigay-kasiyahan sa pagpapalagay ng "mabilis na ekwilibriyo". Kung, gayunpaman, ang k 2 ay maihahambing sa pagkakasunud-sunod ng magnitude sa k -1 ,
ang pagbabago sa konsentrasyon ng enzyme-substrate complex sa paglipas ng panahon ay maaaring ipahayag ng sumusunod na differential equation:
d / dt \u003d k 1 [E] [S] - k -1 - k 2
Dahil isinasaalang-alang namin ang paunang rate ng reaksyon, i.e. ang sandali kapag ang reverse reaction ay hindi pa nangyayari, at ang pre-stationary stage ay lumipas na, pagkatapos ay dahil sa labis na substrate, ang halaga ng nabuo na enzyme-substrate complex ay katumbas ng halaga ng nabulok. ( ang prinsipyo ng stationarity, o ang kinetics nina Briggs at Haldane, o ang prinsipyo ng Bodenstein sa chemical kinetics) at totoo na
d/dt=0
Ang pagpapalit nito sa differential equation, nakakakuha tayo ng expression para sa konsentrasyon ng libreng enzyme:
[E] \u003d (k -1 + k 2) / k 1 [S]
[E] T = [E] + = [(k -1 + k 2) / k -1 [S] + 1] =
= (k -1 + k 2 + k -1 [S]) / k 1 [S]
Equation ng steady state:
K 1 [S] [E] T / (k -1 + k 2 + k 1 [S])
kasi v = k 2 , pagkatapos makuha namin iyon
v = k 1 k 2 [S] [E] T / (k -1 + k 2 + k 1 [S]) = k 2 [S] [E] T / [(k -1 + k 2) / k 1 + [S]]
Sa kasong ito
V max = k 2 [E] T
at katumbas ng pinakamataas na bilis na nakuha mula sa Michaelis-Menten equation. Gayunpaman, ang pare-pareho sa denominator ng Michaelis-Menten equation ay hindi K S ,
mga. hindi ang dissociation constant ng enzyme-substrate complex, ngunit ang tinatawag na Michaelis constant:
K m \u003d (k -1 + k 2) / k 1
Ang K m ay katumbas ng K S lamang kung .
Sa kaso, ang pare-pareho sa denominator ng velocity equation ay ipinahayag ng formula
K k \u003d k 2 / k 1
at tinawag, ayon kay Van Slyke, kinetic constant.
Ang steady state equation ay maaari ding makuha mula sa differential equation nang walang assumption na d / dt = 0. Kung papalitan natin ang value [E] = [E] T - sa differential equation, pagkatapos ng mga transformation ay makukuha natin
= (k 1 [S] [E] T - d / dt) / (k 1 [S] + k -1 + k 2)
Upang makuha ang steady state equation mula sa equation na ito, hindi ito kailangang d / dt = 0. Sapat na ang hindi pagkakapantay-pantay d / dt<< k 1 [S] [E] T . Этим объясняется, почему можно достичь хорошего приближения в течение длительного времени при использовании принципа стационарности.
Ang differentiated steady state equation ay ganito ang hitsura:
d / dt \u003d T / (k 1 [S] + k -1 + k 2) 2] (d [S] / dt)
Ang expression na ito ay malinaw na hindi katumbas ng 0.
1.2 Pagbabago ng Michaelis-Menten equation
Ang orihinal na Michaelis-Menten equation ay isang hyperbolic equation, kung saan ang isa sa mga constants (V max) ay ang asymptote sa curve. Ang isa pang pare-pareho (K m), ang negatibong halaga nito ay tinutukoy ng pangalawang asymptote, ay katumbas ng konsentrasyon ng substrate na kinakailangan upang makamit ang V max / 2. Madali itong i-verify, dahil kung
v=Vmax / 2, pagkatapos
Vmax / 2 = Vmax [S] / (Km + [S])
V max / V max = 1 = 2 [S] / (K m + [S]) m + [S] = 2 [S], ibig sabihin. [S] = K m para sa v = V max /2.
Ang Michaelis-Menten equation ay maaaring algebraically transformed sa iba pang mga form na mas maginhawa para sa graphical na representasyon ng pang-eksperimentong data. Ang isa sa mga pinakakaraniwang pagbabago ay ang pagtumbas lamang ng mga kapalit ng kaliwa at kanang bahagi ng equation.


Bilang resulta ng pagbabago, nakuha namin ang expression

na nagtataglay ng pangalan Mga equation ng Lineweaver-Burk. Ayon sa equation na ito, ang isang graph na naka-plot sa mga coordinate 1/[S] at 1/v ay isang tuwid na linya, ang slope nito ay katumbas ng K m /V max , at ang segment na pinutol sa y-axis ay pantay. hanggang 1/V max. Ang ganitong double reciprocal graph ay may kalamangan na ginagawang posible upang matukoy ang V max nang mas tumpak; sa isang curve na naka-plot sa [S] at v coordinate, ang V max ay isang asymptotic na dami at natutukoy nang hindi gaanong tumpak. Ang segment na pinutol sa x-axis sa Lineweaver-Burk plot ay katumbas ng -1/K m . Ang mahalagang impormasyon tungkol sa pagsugpo ng enzyme ay maaari ding makuha mula sa graph na ito.
Ang isa pang pagbabago ng Michaelis-Menten equation ay ang magkabilang panig ng Lineweaver-Burk equation ay pinarami ng V max *v at pagkatapos ng ilang karagdagang pagbabagong nakukuha natin

Ang katumbas na plot sa v at v/[S] coordinate ay kumakatawan sa e 4, fig. isa]. Ang ganitong graph ( Edie-Hofsty na tsart) hindi lamang ginagawang posible na napakadaling matukoy ang mga halaga ng V max at K m , ngunit nagbibigay-daan din sa iyo na makilala ang mga posibleng paglihis mula sa linearity na hindi nakita sa Lineweaver-Burk plot.
Ang equation ay maaari ding i-linearize sa ibang anyo
[S] / v = K m / V max + [S] / V max
Sa kasong ito, ang pagtitiwala [S] / v sa [S] ay dapat itayo. Ang slope ng nagresultang tuwid na linya ay 1 / V max ; ang mga segment na pinutol sa ordinate at abscissa axes ay katumbas ng (K m / V max) at (- K m), ayon sa pagkakabanggit. Ang tsart na ito ay ipinangalan sa may-akda tsart ng Haynes.
Ipinakita ng pagsusuri sa istatistika na ang mga pamamaraan ng Edie-Hofstee at Haynes ay nagbibigay ng mas tumpak na mga resulta kaysa sa pamamaraang Lineweaver-Burk. Ang dahilan nito ay sa mga graph ng Edie - Hofstee at Haynes, ang parehong umaasa at independiyenteng mga variable ay kasama sa mga halaga na naka-plot sa parehong coordinate axes.
1.3 Epekto ng konsentrasyon ng substrate sa mga kinetika ng reaksyon
Sa maraming mga kaso, ang kondisyon ng patuloy na konsentrasyon ng substrate ay hindi nasiyahan. Sa isang banda, ang labis na substrate ay hindi ginagamit sa in vitro na reaksyon sa ilang mga enzyme dahil sa madalas na nagaganap na pagsugpo sa aktibidad ng enzymatic ng substrate. Sa kasong ito, ang pinakamainam na konsentrasyon lamang ang maaaring gamitin, at hindi ito palaging nagbibigay ng labis na substrate na kinakailangan upang matupad ang mga kinetic equation ng mga mekanismo na tinalakay sa itaas. Bukod dito, sa cell sa vivo, ang labis na substrate na kinakailangan upang matupad ang kundisyong ito ay karaniwang hindi nakakamit.
Sa mga reaksyong enzymatic kung saan ang substrate ay hindi labis at, samakatuwid, ang konsentrasyon nito ay nagbabago sa panahon ng reaksyon, ang dissociation constant ng enzyme-substrate complex ay
K S = ([S] 0 - - [P]) [E] T - )/
([S] 0 - konsentrasyon ng substrate sa t = 0). Sa kasong ito, ang paunang rate ng reaksyon (sa steady state) ay ibinibigay ng
v= V max / (K m + )
kung saan ang konsentrasyon ng substrate sa isang punto ng oras.
Gayunpaman, posibleng magsulat ng tinatayang solusyon para sa dalawang kaso kung saan [S] o = :
) kung ang hindi pagkakapantay-pantay na ito ay nasiyahan dahil sa malalaking halaga ng t, i.e. kapag higit sa 5% ng paunang konsentrasyon ng substrate ay natupok sa panahon ng reaksyon;
) kung ang konsentrasyon ng enzyme ay hindi maaaring pabayaan kumpara sa konsentrasyon ng substrate at sa gayon ang konsentrasyon ng enzyme-substrate complex ay dapat isaalang-alang.
Kung ang t ay malaki at ang konsentrasyon ay bale-wala kumpara sa [S] 0 , kung gayon ang equation para sa dissociation constant ng enzyme-substrate complex ay magiging sumusunod:
K S = ([S] 0 - [P]) ([E] T - ) /
Para sa halaga ng konsentrasyon, na nagbabago sa panahon ng reaksyon, ang halaga ([S] 0 + )/2 ay nagsisilbing isang kasiya-siyang pagtatantya. Dahil = [S] 0 - [P], ang average na bilis; maaaring ipahayag bilang
![]()
Pinapalitan ang expression na ito at ang tinatayang halaga sa
v= V max / (K m + ),
makuha namin:
Kapag inihambing ang mga halaga na kinakalkula batay sa pagtatantya na ito sa mga halaga na nakuha mula sa eksaktong, pinagsamang Michaelis-Menten equation, lumalabas na ang error sa pagtukoy ng K m ay 1 at 4% kapag gumagastos ng 30 at 50% ng substrate, ayon sa pagkakabanggit. Samakatuwid, ang error sa approximation na ito ay bale-wala kumpara sa error sa pagsukat.
Kapag ang pagkonsumo ng substrate ay hindi lalampas sa 5% ng paunang konsentrasyon, ngunit ang konsentrasyon ng enzyme ay napakataas na, kumpara sa [S] 0, hindi ito maaaring balewalain, ang dissociation constant ng enzyme-substrate complex ay pantay. sa:
K s = ([S] 0 - ) ([E] T - ) /
Ang kanyang solusyon tungkol sa mga nagbibigay
Sa dalawang posibleng solusyon, ang negatibo lamang ang maaaring piliin, dahil ito lamang ang nakakatugon sa mga paunang kondisyon: = 0 sa [S] 0 = 0 o [E] T = 0. Sa pamamagitan ng pagkakatulad sa equation para sa ratio na v/V max, nakuha namin ang paunang velocity equation. Ang quadratic equation na nakuha mula sa equation ng dissociation constant ng enzyme-substrate complex, na matatagpuan sa itaas, gamit ang mga formula v \u003d k 2 at V max \u003d k 2 [E] T, ay maaaring bawasan sa sumusunod na anyo:
[S] 0 V max / v = K s V max / (V max - v) + [E] T
Dapat isaalang-alang ang dalawang limitadong kaso. Sa unang kaso [S]<
v = (Vmax / Km) [S] = k[S]
Kaya, nakuha namin ang maliwanag na unang pagkakasunud-sunod na reaksyon at k=V max /K m - ang maliwanag na unang pagkakasunud-sunod na kinetic constant. Ang aktwal na dimensyon nito ay oras -1 , ngunit ito ay kumbinasyon ng una at pangalawang order rate constants ng ilang elementary stages, i.e. k 1 k 2 [E] T /(k -1 + k 2) . Sa ilalim ng mga kondisyon ng maliwanag na unang order k ay isang sukatan ng pag-unlad ng reaksyon.
Isa pang naglilimitang kaso: [S] >>
K m .
Dito ang pare-parehong K m
ay bale-wala kumpara sa [S], at sa gayon ay nakukuha natin ang v = V max .
1.4 Pagbuo ng isang kinetically stable na enzyme-product complex
Kung ang isang kinetically stable na enzyme-product complex ay nabuo sa panahon ng reaksyon, ang mekanismo ng reaksyon ay ang mga sumusunod:
Sa paglalapat ng steady state assumption, maaari nating isulat ang mga differential equation:
d / dt = k 1 [E] [S] + k -2 - (k -1 + k 2) = 0 / dt = k 2 - (k -2 + k 3) = 0
Mula sa mga equation na ito ay sinusundan iyon
= [(k -2 + k 3) / k 2]
[E] = [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 k 2 [S]]
Dahil v = k 3
at [E] T = [E] + + =
= [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 k 2 [S] + (k -2 + k 3) / k 2 + 1] =
= ( (k -2 + k 3) + k 1 k 2 [S]] / k 1 k 2 [S])
nakukuha natin
K 1 k 2 [S] [E] T / (k -2 + k 3 + k 2)]= k 1 k 2 k 3 [S] [E] T / (k -2 + k 3 + k 2) ]=
= [E] T [S] / [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 (k -2 + k 3 + k 2) + [S]]
Yan ay
V max \u003d [E] Tm \u003d (k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 (k -2 + k 3 + k 2)
Sa kasong ito, napakahirap na kalkulahin ang mga tiyak na halaga ng mga indibidwal na mga constant ng rate, dahil ang kanilang ratio lamang ang maaaring masukat nang direkta. Ang sitwasyon ay mas kumplikado kapag ang mekanismo ng reaksyon ng enzymatic ay nagiging mas kumplikado, kapag higit sa dalawang complex ang lumahok sa reaksyon, dahil ang bilang ng mga rate ng constant sa equation ay natural na mas malaki, at ang kanilang mga ratio ay mas kumplikado din.
Gayunpaman, ang sitwasyon ay pinasimple kung, pagkatapos ng mababalik na reaksyon ng pagbuo ng unang kumplikado, ang kasunod na mga hakbang sa elementarya ay hindi maibabalik. Ang mga mahahalagang kinatawan ng mga enzyme na sumusunod sa mekanismong ito ay mga proteolytic enzymes at esterases. Ang mekanismo ng kanilang reaksyon ay maaaring isulat tulad ng sumusunod:
kung saan ang ES` ay isang acyl-enzyme intermediate na nabubulok sa pagkakalantad sa tubig. Pwede tayong magsulat
V max \u003d k 2 k 3 [E] 0 / (k 2 + k 3) \u003d k cat [E] 0m \u003d k 3 (k -1 + k 2) / (k 2 + k 3) k 1 pusa / K m \u003d k 2 k 1 / (k -1 + k 2) \u003d k 2 / K m '
Ang Michaelis constant ng acylation step ay K m "K s. Kung mas malaki ang ratio k cat / K m , mas mataas ang specificity ng substrate.
Ang pagpapasiya ng mga constant ay lubos na pinasimple kung ang eksperimento ay isinasagawa sa pagkakaroon ng isang nucleophilic agent (N) na may kakayahang makipagkumpitensya sa tubig. Pagkatapos

Ang k 3 \u003d k 3 ’ at P i (i \u003d 1, 2, 3) ay mga produkto.
vi = k pusa, i [S] / (K m + [S]) pusa, 1 = k 2 (k 3 + k 4 [N]) / (k 2 + k 3 + k 4 [N]) pusa, 2 = k 2 k 3 / (k 2 + k 3 + k 4 [N]) pusa, 3 = k 2 k 4 [N] / (k 2 + k 3 + k 4 [N]) m = K s ( k 3 + k 4 [N]) / (k 2 + k 3 + k 4 [N])
/v N = K s (k 3 + k 4 [N]) / k 2 k 3 [S] + (k 2 + k 3 + k 4 [N]) / k 2 k 3
Dahil alam na K s / k 2 = K m / k pusa, at kung wala ang nucleophile, kung gayon
1/v = K s / k 2 [S] + (k 2 + k 3) / k 2 k 3
at upang matukoy ang mga constant, maaari mong gamitin ang punto ng intersection ng mga linya sa mga coordinate 1/v N (at 1/v) - 1/[S]. Dalawang tuwid na linya sa dobleng kabaligtaran na mga coordinate ay nagsalubong sa pangalawang kuwadrante. Sa kawalan ng nucleophile, ang punto ng intersection ng linya na may vertical axis ay tinukoy bilang 1/V max at 1/k cat , at may pahalang na axis bilang -1/K m . Ang mga coordinate ng punto ng intersection ng dalawang linya: -1/K s at 1/k 3 . Ang distansya sa pagitan ng 1/V max at 1/k 3 ay 1/k 2 .
1.5 Pagsusuri ng kumpletong kinetic curve ng reaksyon
Ang Michaelis - Menten equation sa orihinal nitong anyo ay tumutukoy lamang sa mga hindi maibabalik na reaksyon, i.e. sa mga reaksyon kung saan ang paunang rate lamang ang isinasaalang-alang, at ang kabaligtaran na reaksyon ay hindi lilitaw dahil sa hindi sapat na dami ng produkto at hindi nakakaapekto sa rate ng reaksyon. Sa kaso ng isang hindi maibabalik na reaksyon, ang kumpletong kinetic curve ay madaling masuri (para sa isang arbitrary na agwat ng oras t ),
pagsasama ng orihinal na Michaelis-Menten equation. Sa kasong ito, samakatuwid, ang pagpapalagay ay nananatiling isang intermediate enzyme-substrate complex lamang ang nabuo sa kurso ng reaksyon. Dahil para sa pagitan ng oras t
walang mga paghihigpit, ang konsentrasyon ng substrate sa oras ng pagsusuri ay hindi maaaring katumbas ng unang ipinakilala na konsentrasyon. Kaya, kinakailangan ding isaalang-alang ang pagbabago sa [S] sa panahon ng reaksyon. Hayaan ang S 0 ang paunang konsentrasyon ng substrate, (S 0 - y )
- konsentrasyon sa oras t .
Pagkatapos, batay sa orihinal na Michaelis-Menten equation (kung y
ay ang halaga ng substrate na na-convert), maaari naming isulat
dy / dt \u003d V max (S 0 - y) / (K m + S 0 - y)
Ang pagkuha ng mga reciprocal at paghahati ng mga variable, isinasama namin ang y
sa pagitan ng 0 at y
(Ang V max ay ipinahiwatig bilang V):
(2.303 / t) lg = V / K m - (1 / K m) (y / t)
Kaya, ang pag-plot ng dependence ng kaliwang bahagi ng equation sa y / t (Foster-Niemann coordinates) ,
kumuha ng tuwid na linya na may slope (-1/K m) ,
cutoff na segment sa y-axis (V/K m) ,
at sa abscissa axis - ang segment V. Ang integral equation ay maaari ding i-linearize sa ibang paraan:
t / 2.3031 lg = y / 2.303 V lg + K m / V
o t/y = 2.3031 K m lg / V y +1/V
Kung pinag-aaralan natin ang isang reversible reaction, kailangang bigyang-pansin kung anong agwat ng oras ang ating kinakaharap. Sa sandali ng paghahalo ng enzyme sa substrate, nagsisimula ang tinatawag na pre-stationary phase, na tumatagal ng ilang micro- o milliseconds, kung saan nabuo ang mga enzyme-substrate complex na naaayon sa nakatigil na estado. Sa pag-aaral ng mga nababaligtad na reaksyon sa sapat na mahabang agwat ng panahon, ang bahaging ito ay hindi gumaganap ng isang mahalagang papel, dahil sa yugtong ito ang reaksyon ay hindi nagpapatuloy sa buong bilis sa alinman sa mga direksyon.
Para sa isang reaksyon na nagpapatuloy mula kaliwa hanggang kanan, ang mga enzyme-substrate complex na kasangkot sa reaksyon ay umaabot sa rate-limiting concentration lamang sa dulo ng prestationary phase. Quasi-stationary na estado, kung saan ang mga konsentrasyon ng mga kumplikadong enzyme-substrate na tumutukoy sa rate ay lumalapit sa pinakamataas na halaga ng mga konsentrasyon sa matatag na estado, ay tumatagal ng ilang ikasampu ng isang segundo o isang segundo. Sa yugtong ito, ang rate ng pagbuo ng produkto (o pagkonsumo ng substrate) ay halos linear sa oras. Sa teoryang, ang pagbuo ng produkto ay hindi pa naganap dito, ngunit sa pagsasagawa ng konsentrasyon nito ay napakababa na ang rate ng reverse reaction ay hindi nakakaapekto sa rate ng direktang isa. Ang linear phase na ito ay tinatawag na initial reaction rate, at sa ngayon ay isinasaalang-alang pa lamang natin ito.
Ang reaksyon mula kanan pakaliwa sa susunod na yugto ay pinabilis din dahil sa unti-unting pagtaas ng konsentrasyon ng produkto. (katayuan ng paglipat; ang linearity na naobserbahan sa ngayon ay nawawala). Ang yugtong ito ay nagpapatuloy hanggang ang bilis ng reaksyon mula kaliwa hanggang kanan ay maging katumbas ng bilis ng reaksyon mula kanan pakaliwa. Ito ang estado dynamic na balanse, dahil ang reaksyon ay nagpapatuloy sa magkabilang direksyon sa parehong bilis.
2. Mga salik kung saan nakasalalay ang bilis ng reaksyong enzymatic
.1 Pag-asa ng enzymatic reaction rate sa temperatura
Sa isang pagtaas sa temperatura ng daluyan, ang rate ng reaksyon ng enzymatic ay tumataas, na umaabot sa isang maximum sa ilang pinakamainam na temperatura, at pagkatapos ay bumaba sa zero. Para sa mga reaksiyong kemikal, mayroong isang panuntunan na sa pagtaas ng temperatura ng 10 ° C, ang rate ng reaksyon ay tumataas ng dalawa hanggang tatlong beses. Para sa mga reaksyong enzymatic, ang koepisyent ng temperatura na ito ay mas mababa: para sa bawat 10°C, ang rate ng reaksyon ay tumataas ng isang salik na 2 o mas mababa pa. Ang kasunod na pagbaba sa rate ng reaksyon sa zero ay nagpapahiwatig ng denaturation ng enzyme block. Ang pinakamainam na halaga ng temperatura para sa karamihan ng mga enzyme ay nasa hanay na 20 - 40 0 C. Ang thermolability ng mga enzyme ay nauugnay sa kanilang istraktura ng protina. Ang ilang mga enzyme ay na-denatured na sa temperatura na humigit-kumulang 40 0 C, ngunit karamihan sa kanila ay hindi aktibo sa mga temperatura sa itaas 40 - 50 0 C. Ang ilang mga enzyme ay hindi aktibo sa pamamagitan ng malamig, i.e. sa mga temperatura na malapit sa 0°C, nangyayari ang denaturation.
Ang pagtaas ng temperatura ng katawan (lagnat) ay nagpapabilis ng mga biochemical reaction na na-catalyze ng mga enzyme. Madaling kalkulahin na ang pagtaas ng temperatura ng katawan para sa bawat antas ay nagpapataas ng rate ng reaksyon ng halos 20%. Sa mataas na temperatura na humigit-kumulang 39-40°C, ang maaksayang paggamit ng mga endogenous substrates sa mga selula ng isang may sakit na organismo ay kinakailangan upang mapunan ang kanilang paggamit ng pagkain. Bilang karagdagan, sa isang temperatura na humigit-kumulang 40°C, ang ilan sa mga pinaka-thermolabile na enzyme ay maaaring ma-denatured, na nakakagambala sa natural na kurso ng mga biochemical na proseso.
Ang mababang temperatura ay nagdudulot ng nababaligtad na hindi aktibo ng mga enzyme dahil sa isang bahagyang pagbabago sa spatial na istraktura nito, ngunit sapat na upang maputol ang kaukulang pagsasaayos ng aktibong sentro at mga molekula ng substrate.
2.2 Pagdepende ng rate ng reaksyon sa pH ng medium
Para sa karamihan ng mga enzyme, mayroong isang tiyak na halaga ng pH kung saan ang kanilang aktibidad ay pinakamataas; sa itaas at sa ibaba ng halagang ito ng pH, bumababa ang aktibidad ng mga enzyme na ito. Gayunpaman, hindi sa lahat ng kaso ang mga kurba na naglalarawan sa pagtitiwala ng aktibidad ng enzyme sa pH ay hugis kampana; minsan ang pag-asa na ito ay maaari ding direktang ipahayag. Ang pag-asa ng rate ng reaksyon ng enzymatic sa pH ay pangunahing nagpapahiwatig ng estado ng mga functional na grupo ng aktibong sentro ng enzyme. Ang pagbabago ng pH ng daluyan ay nakakaapekto sa ionization ng acidic at pangunahing mga grupo ng mga residue ng amino acid ng aktibong sentro, na kasangkot sa alinman sa pagbubuklod ng substrate (sa lugar ng contact) o sa pagbabagong-anyo nito (sa catalytic area). Samakatuwid, ang tiyak na epekto ng pH ay maaaring sanhi ng alinman sa isang pagbabago sa affinity ng substrate para sa enzyme, o sa pamamagitan ng isang pagbabago sa catalytic na aktibidad ng enzyme, o pareho.
Karamihan sa mga substrate ay may acidic o pangunahing mga grupo, kaya ang pH ay nakakaapekto sa antas ng ionization ng substrate. Ang enzyme ay mas mainam na nagbubuklod sa alinman sa ionized o non-ionized na anyo ng substrate. Malinaw, sa pinakamainam na pH, ang parehong mga functional na grupo ng aktibong sentro ay nasa pinaka-reaktibong estado, at ang substrate ay nasa isang anyo na mas mainam para sa pagbubuklod ng mga pangkat na ito ng enzyme.
Kapag nagtatayo ng mga curve na naglalarawan sa pag-asa ng aktibidad ng enzyme sa pH, ang mga pagsukat sa lahat ng mga halaga ng pH ay karaniwang isinasagawa sa ilalim ng mga kondisyon ng saturation ng enzyme na may substrate, dahil ang halaga ng K m para sa maraming mga enzyme ay nagbabago sa pH.
Ang curve na nagpapakilala sa pag-asa ng aktibidad ng enzyme sa pH ay maaaring magkaroon ng isang partikular na simpleng hugis sa mga kaso kung saan ang enzyme ay kumikilos sa electrostatically neutral na mga substrate o substrate kung saan ang mga naka-charge na grupo ay hindi gumaganap ng isang mahalagang papel sa catalytic act. Ang isang halimbawa ng naturang mga enzyme ay ang papain, pati na rin ang invertase, na nag-catalyze sa hydrolysis ng mga neutral na molekula ng sucrose at nagpapanatili ng isang pare-parehong aktibidad sa hanay ng pH na 3.0-7.5.
Ang halaga ng pH na naaayon sa pinakamataas na aktibidad ng enzyme ay hindi kinakailangang tumutugma sa katangian ng pH value ng normal na intracellular na kapaligiran ng enzyme na ito; ang huli ay maaaring nasa itaas at mas mababa sa pinakamainam na pH. Iminumungkahi nito na ang epekto ng pH sa aktibidad ng enzyme ay maaaring isa sa mga kadahilanan na responsable para sa regulasyon ng aktibidad ng enzymatic sa loob ng cell. Dahil ang cell ay naglalaman ng daan-daang mga enzyme, at ang bawat isa sa kanila ay tumutugon nang iba sa mga pagbabago sa pH, ang halaga ng pH sa loob ng cell ay marahil ang isa sa mga mahahalagang elemento sa kumplikadong sistema ng regulasyon ng cellular metabolism.
2.3 Pagtukoy sa dami ng enzyme sa pamamagitan ng aktibidad nito
) ang kabuuang stoichiometry ng catalyzed na reaksyon;
) ang posibleng pangangailangan para sa mga cofactor - sa mga metal ions o coenzymes;
) ang pag-asa ng aktibidad ng enzyme sa mga konsentrasyon ng substrate at cofactor, i.e. Mga halaga ng K m para sa parehong substrate at cofactor;
) ang halaga ng pH na naaayon sa pinakamataas na aktibidad ng enzyme;
) ang hanay ng temperatura kung saan ang enzyme ay matatag at nagpapanatili ng mataas na aktibidad.
Bilang karagdagan, ito ay kinakailangan upang magkaroon sa iyong pagtatapon ng ilang medyo simpleng analytical na pamamaraan na nagbibigay-daan sa iyo upang matukoy ang rate ng pagkawala ng substrate o ang rate ng hitsura ng mga produkto ng reaksyon.
Hangga't maaari, ang pagsusuri ng enzyme ay isinasagawa sa ilalim ng mga karaniwang kondisyon na nagpapanatili ng pinakamainam na pH at nagpapanatili ng konsentrasyon ng substrate sa itaas ng konsentrasyon ng saturation; sa kasong ito, ang paunang rate ay tumutugma sa zero order ng reaksyon na may paggalang sa substrate at proporsyonal lamang sa konsentrasyon ng enzyme. Para sa mga enzyme na nangangailangan ng mga cofactor, metal ions o coenzymes, ang konsentrasyon ng mga cofactor na ito ay dapat ding lumampas sa saturation concentration upang ang enzyme concentration ay ang rate-limiting factor. Sa pangkalahatan, ang pagsukat ng rate ng pagbuo ng produkto ng reaksyon ay maaaring isagawa nang may higit na katumpakan kaysa sa pagsukat ng rate ng pagkawala ng substrate, dahil ang substrate sa pangkalahatan ay dapat na naroroon sa medyo mataas na konsentrasyon upang mapanatili ang zero order kinetics. Ang rate ng pagbuo ng produkto ng reaksyon (o mga produkto) ay maaaring masukat sa pamamagitan ng kemikal o spectrum-photometric na pamamaraan. Ang pangalawang paraan ay mas maginhawa, dahil pinapayagan ka nitong patuloy na i-record ang kurso ng reaksyon sa mite ng recorder.
Sa pamamagitan ng internasyonal na kasunduan, ang isang yunit ng aktibidad ng enzymatic ay ang dami ng enzyme na may kakayahang magdulot ng conversion ng isang micromole ng substrate kada minuto sa 25°C sa ilalim ng pinakamainam na kondisyon. Partikular na aktibidad Ang enzyme ay ang bilang ng mga yunit ng aktibidad ng enzymatic bawat 1 mg ng protina. Ang halagang ito ay ginagamit bilang isang criterion para sa kadalisayan ng paghahanda ng enzyme; ito ay tumataas habang ang enzyme ay dinadalisay at umabot sa pinakamataas na halaga nito para sa perpektong dalisay na paghahanda. Sa ilalim bilang ng mga rebolusyon maunawaan ang bilang ng mga molekula ng substrate na sumasailalim sa pagbabagong-anyo bawat yunit ng oras bawat isang molekula ng enzyme (o bawat isang aktibong sentro) sa ilalim ng mga kondisyon kung saan ang bilis ng reaksyon ay nililimitahan ng konsentrasyon ng enzyme.
2.4 Pag-activate ng enzyme
Ang regulasyon ng mga enzyme ay maaaring isagawa sa pamamagitan ng pakikipag-ugnayan sa kanila ng iba't ibang biological na bahagi o mga dayuhang compound (halimbawa, mga gamot at lason), na karaniwang tinatawag mga modifier o mga regulator mga enzyme. Sa ilalim ng impluwensya ng mga modifier sa enzyme, ang reaksyon ay maaaring mapabilis (mga activator) o mabagal. ( mga inhibitor).
Ang pag-activate ng mga enzyme ay natutukoy sa pamamagitan ng pagpabilis ng mga biochemical reaksyon na nangyayari pagkatapos ng pagkilos ng modifier. Ang isang pangkat ng mga activator ay binubuo ng mga sangkap na nakakaapekto sa rehiyon ng aktibong site ng enzyme. Kabilang dito ang mga enzyme cofactor at substrate. Ang mga cofactor (metal ions at coenzymes) ay hindi lamang mga obligadong elemento ng istruktura ng mga kumplikadong enzyme, kundi pati na rin ang kanilang mga activator.
Ang mga metal ions ay medyo tiyak na mga activator. Kadalasan, ang ilang mga enzyme ay nangangailangan ng mga ion ng hindi isa, ngunit ilang mga metal. Halimbawa, para sa Na + , K + -ATPase, na nagdadala ng mga monovalent na cation sa pamamagitan ng cell membrane, ang magnesium, sodium at potassium ions ay kinakailangan bilang mga activator.
Ang pag-activate sa tulong ng mga metal ions ay isinasagawa ng iba't ibang mga mekanismo. Sa ilang mga enzyme, sila ay bahagi ng catalytic site. Sa ilang mga kaso, pinadali ng mga ion ng metal ang pagbubuklod ng substrate sa aktibong sentro ng enzyme, na bumubuo ng isang uri ng tulay. Kadalasan, ang metal ay hindi pinagsama sa enzyme, ngunit sa substrate, na bumubuo ng isang metal-substrate complex, na kung saan ay lalong kanais-nais para sa pagkilos ng enzyme.
Ang pagtitiyak ng pakikilahok ng mga coenzymes sa pagbubuklod at catalysis ng substrate ay nagpapaliwanag sa pag-activate ng mga reaksyon ng enzymatic ng mga ito. Ang epekto ng pag-activate ng mga cofactor ay lalong kapansin-pansin kapag kumikilos sa isang enzyme na hindi puspos ng mga cofactor.
Ang substrate ay isa ring activator sa loob ng mga kilalang limitasyon ng konsentrasyon. Matapos maabot ang saturating na konsentrasyon ng substrate, ang aktibidad ng enzyme ay hindi tumataas. Pinapataas ng substrate ang katatagan ng enzyme at pinapadali ang pagbuo ng nais na conformation ng aktibong site ng enzyme.
Mga metal ions, coenzymes at ang kanilang mga precursor at aktibong analogues,
ang mga substrate ay maaaring gamitin sa pagsasanay bilang mga paghahanda na nagpapagana ng mga enzyme.
Ang pag-activate ng ilang mga enzyme ay maaaring isagawa sa pamamagitan ng pagbabago na hindi nakakaapekto sa aktibong sentro ng kanilang mga molekula. Maraming mga pagbabago ang posible:
1) pag-activate ng isang hindi aktibong hinalinhan - proenzyme, o zymogen. Halimbawa, ang conversion ng pepsinogen sa pepsin ;
2) pag-activate sa pamamagitan ng paglakip ng anumang partikular na pangkat ng pagbabago sa molekula ng enzyme;
3) activation sa pamamagitan ng dissociation ng isang hindi aktibong kumplikadong protina - aktibong enzyme.
2.5 Enzyme inhibition
May mga reagents na maaaring makipag-ugnayan nang higit pa o mas kaunti partikular sa isa o ibang side chain ng mga protina, na humahantong sa pagsugpo sa aktibidad ng enzyme. Ginagawang posible ng hindi pangkaraniwang bagay na ito na pag-aralan ang likas na katangian ng mga residue ng panig ng amino acid na kasangkot sa reaksyong enzymatic na ito. Gayunpaman, sa pagsasagawa, dapat isaalang-alang ng isa ang maraming mga subtleties na gumagawa ng isang hindi malabo na interpretasyon ng mga resulta na nakuha sa mga tiyak na inhibitor sa halip mahirap at madalas na nagdududa. Una sa lahat, para ang reaksyon sa isang inhibitor ay angkop para sa pag-aaral ng likas na katangian ng mga side chain na kasangkot sa reaksyon, dapat itong matugunan ang mga sumusunod na pamantayan:
) maging tiyak, i.e. ang inhibitor ay dapat harangan lamang ang nais na mga grupo;
) pagbawalan ang aktibidad ng enzyme, at ang pagsugpo na ito ay dapat maging kumpleto sa pagtaas ng bilang ng mga binagong grupo;
) ang reagent ay hindi dapat maging sanhi ng di-tiyak na denaturation ng protina.
Mayroong 2 grupo ng mga inhibitor: nababaligtad at hindi maibabalik na pagkilos. Ang paghahati ay batay sa pamantayan para sa pagpapanumbalik ng aktibidad ng enzyme pagkatapos ng dialysis o isang malakas na pagbabanto ng isang solusyon ng enzyme na may isang inhibitor.
Ayon sa mekanismo ng pagkilos, ang mapagkumpitensya, hindi mapagkumpitensya, hindi mapagkumpitensya, substrate at allosteric inhibition ay nakikilala.
Competitive inhibition
Ang mapagkumpitensyang pagsugpo ay natuklasan sa pag-aaral ng pagsugpo na dulot ng mga analogue ng substrate. Ito ang pagsugpo sa reaksyon ng enzymatic na sanhi ng pagbubuklod sa aktibong sentro ng enzyme ng isang inhibitor na katulad ng istraktura sa substrate at pinipigilan ang pagbuo ng isang enzyme-substrate complex. Sa mapagkumpitensyang pagsugpo, ang inhibitor at substrate, na magkatulad sa istraktura, ay nakikipagkumpitensya para sa aktibong site ng enzyme. Ang tambalan ng mga molekula, na mas malaki, ay nagbubuklod sa aktibong sentro.
Ang ganitong mga ideya tungkol sa mekanismo ng pagsugpo ay nakumpirma ng mga eksperimento sa mga kinetika ng mapagkumpitensyang mga reaksyon sa pagsugpo. Kaya, ipinakita na, sa kaso ng mapagkumpitensyang pagsugpo, ang substrate analog ay hindi nakakaapekto sa rate ng agnas ng nabuo nang enzyme-substrate complex; kapag gumagamit ng isang "walang hanggan na malaki" na labis ng substrate, ang parehong maximum na rate ay nakuha kapwa sa presensya at sa kawalan ng isang inhibitor. Sa kabaligtaran, ang inhibitor ay nakakaapekto sa halaga ng dissociation constant at ang Michaelis constant. Mula dito maaari nating tapusin na ang inhibitor ay tumutugon sa mga grupo ng protina na kasangkot sa isang paraan o iba pa sa pagbubuklod sa substrate, samakatuwid, dahil sa pakikipag-ugnayan nito sa mga pangkat na ito, bumababa ang lakas ng pagbubuklod ng substrate (ibig sabihin, ang bilang ng mga molekula ng enzyme na may kakayahang nababawasan ang pagbubuklod sa substrate) .
Nang maglaon, ipinakita na ang kinetically competitive inhibition ay maaaring sanhi hindi lamang ng mga substrate analogues, kundi pati na rin ng iba pang mga reagents, ang kemikal na istraktura na kung saan ay ganap na naiiba mula sa substrate. Sa mga kasong ito, ipinapalagay din na ang reagent na ito ay nakikipag-ugnayan sa pangkat na responsable para sa pagbubuklod sa substrate.
Mayroong dalawang teoretikal na posibilidad para sa mapagkumpitensyang pagsugpo:
1) nagbubuklod at catalytic site ng enzyme overlap; ang inhibitor ay nagbubuklod sa kanila, ngunit nakakaapekto lamang sa mga nagbubuklod na grupo ng sentro;
2) ang binding center at ang catalytic center sa enzyme molecule ay spatially isolated; nakikipag-ugnayan ang inhibitor sa binding site.

kung saan ang I ay isang inhibitor, at ang K I ay ang dissociation constant ng enzyme-inhibitor complex.
Relative rate (ratio ng enzymatic reaction rate na sinusukat sa pagkakaroon ng isang inhibitor (v i) ,
sa pinakamataas na bilis) ay katumbas ng
v i / V = / [E] T
dahil para sa kabuuang konsentrasyon ng enzyme ito ay totoo
[E]T = [E] + +
pagkatapos ay 1 / v i = (K s / V[S]) (1 + [I] / K I) + 1 / V
Malinaw, kung [I] = K I , pagkatapos ay ang slope ng tuwid na linya ay nagiging dalawang beses na mas malaki kaysa sa pag-asa ng 1/v 0 sa [S] (v 0 ay ang rate ng enzymatic reaction sa kawalan ng isang inhibitor).
Ang uri ng pagsugpo ay karaniwang tinutukoy ng graphical. Ang mapagkumpitensyang pagsugpo ay pinakamadaling makilala sa pamamagitan ng paglalagay ng mga plot ng Lineweaver-Burk (ibig sabihin, mga plot sa 1/v i at 1/[S]) sa iba't ibang konsentrasyon ng inhibitor. Sa tunay na mapagkumpitensyang pagsugpo, isang hanay ng mga tuwid na linya ay nakuha na naiiba sa tangent ng slope angle at bumalandra sa y-axis (axis 1/v i) sa isang punto. Sa anumang konsentrasyon ng inhibitor, posible na gumamit ng napakataas na konsentrasyon ng substrate na ang aktibidad ng enzyme ay magiging maximum.
Ang isang halimbawa ng mapagkumpitensyang pagsugpo ay ang epekto ng iba't ibang mga sangkap sa aktibidad ng succinate dehydrogenase. Ang enzyme na ito ay bahagi ng enzymatic cyclic system - ang Krebs cycle. Ang natural na substrate nito ay succinate, at ang mapagkumpitensyang inhibitor nito ay oxaloacetate, isang intermediate na produkto ng parehong Krebs cycle:
Ang isang katulad na mapagkumpitensyang inhibitor ng succinate dehydrogenase ay malonic acid, na kadalasang ginagamit sa biochemical research.
Ang pagkilos ng maraming paghahanda sa parmasyutiko, mga pestisidyo na ginagamit upang sirain ang mga peste sa agrikultura, at mga ahente sa pakikipagdigma ng kemikal ay batay sa prinsipyo ng mapagkumpitensyang pagsugpo.
Halimbawa, ang isang pangkat ng mga anticholinesterase na gamot, na kinabibilangan ng mga derivatives ng quaternary ammonium base at organophosphorus compound, ay mga mapagkumpitensyang inhibitor ng cholinesterase enzyme na may kinalaman sa substrate na acetylcholine nito. Ang Cholinesterase ay nag-catalyze ng hydrolysis ng acetylcholine, isang tagapamagitan ng mga cholinergic system (neuromuscular synapses, parasympathetic system, atbp.). Ang mga sangkap na anticholinesterase ay nakikipagkumpitensya sa acetylcholine para sa aktibong site ng enzyme, nagbubuklod dito, at pinapatay ang catalytic na aktibidad ng enzyme. Ang mga gamot tulad ng prozerin, physostigmine, sevin ay pumipigil sa enzyme na baligtarin, habang ang mga organophosphorus na gamot tulad ng armin, nibufin, chlorophos, soman ay kumikilos nang hindi maibabalik, phosphorylating ang catalytic group ng enzyme. Bilang resulta ng kanilang pagkilos, ang acetylcholine ay naipon sa mga synapses na iyon kung saan ito ay isang tagapamagitan ng nervous excitation, i.e. ang organismo ay nalason ng naipon na acetylcholine. Ang pagkilos ng nababaligtad na mga inhibitor ay unti-unting nawawala, dahil ang mas maraming acetylcholine ay naipon, mas mabilis nitong inilipat ang inhibitor mula sa aktibong sentro ng cholinesterase. Ang toxicity ng hindi maibabalik na mga inhibitor ay hindi maihahambing na mas mataas; samakatuwid, ginagamit ang mga ito upang labanan ang mga peste sa agrikultura, mga insekto sa sambahayan at mga daga (halimbawa, chlorophos) at bilang mga ahente sa pakikipagdigma ng kemikal (halimbawa, sarin, soman, atbp.).
Noncompetitive na pagsugpo
Sa non-competitive inhibition, ang isang partikular na inhibitor ay hindi nakakaapekto sa dissociation constant ng enzyme-substrate complex. Sa kabilang banda, ang maximum na matamo na rate ng reaksyon ay mas mababa sa pagkakaroon ng isang inhibitor kaysa sa kawalan nito, kahit na sa isang walang katapusang malaking labis ng substrate. Ang pagkakaroon ng pagsugpo ay nagpapatunay na ang inhibitor ay nagbubuklod sa protina. Ang invariance ng dissociation constant pareho sa presensya at kawalan ng inhibitor, sa turn, ay nagpapahiwatig na, hindi katulad ng substrate, ang inhibitor ay nagbubuklod sa ibang grupo. Mula sa isang teoretikal na pananaw, ang mekanismo ng naturang pagsugpo ay maaaring bigyang-kahulugan sa iba't ibang paraan.
a) Magkaiba ang binding site at ang catalytic site ng enzyme. Sa kasong ito, binabawasan ng inhibitor na nauugnay sa catalytic center ang aktibidad ng enzyme at ang maximum na makakamit
bilis nang hindi naaapektuhan ang pagbuo ng enzyme-substrate complex.
b) Ang binding site at ang catalytic site ay magkakapatong sa
ibabaw ng enzyme, at ang inhibitor ay nagbubuklod sa ibang mga grupo ng protina. Dahil sa pagbubuklod ng inhibitor sa ibabaw ng enzyme, ang impormasyon ng protina ay nagbabago at nagiging hindi kanais-nais para sa pagpapatupad ng catalysis.
c) Ang inhibitor ay hindi nagbubuklod sa alinman sa catalytic site o sa binding site, at sa gayon ay hindi nakakaapekto sa conformation ng protina. Gayunpaman, maaari nitong lokal na baguhin ang pamamahagi ng singil sa isang rehiyon ng ibabaw ng protina. Ang pagsugpo sa aktibidad ay maaari ding mangyari sa kasong ito kung, halimbawa, ang ionization ng mga pangkat na mahalaga para sa pagpapakita ng aktibidad ay ginawang imposible, o kung, sa kabaligtaran, ang ionization ng mga grupo na aktibo lamang sa non-ionized na anyo ay nangyayari. Ang hindi pangkaraniwang bagay na ito ay naobserbahan pangunahin kapag gumagamit ng malakas na acidic o malakas na alkaline reagents.
Ang inhibitor at ang substrate ay hindi nakakaapekto sa pagbubuklod ng isa't isa sa enzyme, ngunit ang mga enzyme complex na naglalaman ng inhibitor ay ganap na hindi aktibo. Sa kasong ito, ang mga sumusunod na elementarya ay maaaring ipalagay:

v i / V = / [E] T
[E] T = [E] + + +
/ v i = (K s / V [S]) (1 + [I] / K I) + (1 / V) (1 + [I] / K I)
Kung [I] = K I, ang mga slope ng mga tuwid na linya at ang mga ordinate ng punto ng intersection na may vertical axis ay dinoble kumpara sa 1/v 0 .
Ang mga non-competitive inhibitors ay, halimbawa, cyanides, na malakas na nauugnay sa ferric iron, na bahagi ng catalytic site ng hemin enzyme - cytochrome oxidase. Ang blockade ng enzyme na ito ay pinapatay ang respiratory chain, at ang cell ay namatay. Kabilang sa mga non-competitive enzyme inhibitors ang mga heavy metal ions at ang kanilang mga organic compound. Samakatuwid, ang mga mabibigat na metal na ion ng mercury, lead, cadmium, arsenic at iba pa ay lubhang nakakalason. Hinaharang nila, halimbawa, ang mga SH-group na kasama sa catalytic site ng enzyme.
Ang mga non-competitive inhibitors ay mga cyanides, na malakas na nauugnay sa ferric iron, na bahagi ng catalytic site ng hemic enzyme - cytochrome oxidase. Ang blockade ng enzyme na ito ay pinapatay ang respiratory chain, at ang cell ay namatay. Imposibleng alisin ang pagkilos ng isang hindi mapagkumpitensya na inhibitor na may labis na substrate (bilang ang pagkilos ng isang mapagkumpitensya), ngunit sa mga sangkap lamang na nagbubuklod sa inhibitor - mga reactivator.
Ang mga non-competitive inhibitors ay ginagamit bilang mga pharmacological agent, mga nakakalason na sangkap para sa pagkontrol ng peste sa agrikultura at para sa mga layuning militar. Sa gamot, ang mga paghahanda na naglalaman ng mercury, arsenic, bismuth ay ginagamit, na hindi mapagkumpitensya na pumipigil sa mga enzyme sa mga selula ng katawan o pathogenic bacteria, na tumutukoy sa isa o isa pa sa kanilang mga epekto. Sa kaso ng pagkalasing, ang pagbubuklod ng lason o ang pag-aalis nito mula sa enzyme-inhibitor complex ay posible sa tulong ng mga reactivator. Kabilang dito ang lahat ng complexone na naglalaman ng SH (cysteine, dimercaptopropanol), citric acid, ethylenediaminetetraacetic acid, atbp.
Hindi mapagkumpitensyang pagsugpo
Ang ganitong uri ng pagsugpo ay tinatawag ding anticompetitive inhibition sa panitikan. o nauugnay na pagsugpo , gayunpaman, ang terminong "hindi mapagkumpitensyang pagsugpo" ang pinakamalawak na ginagamit. Ang katangian ng ganitong uri ng pagsugpo ay ang inhibitor ay hindi nakakabit sa enzyme, ngunit ito ay nakakabit sa enzyme-substrate complex.
Sa kaso ng hindi mapagkumpitensyang pagsugpo, ang complex na naglalaman ng inhibitor ay hindi aktibo:

v i / V = / [E]
[E]T = [E] + +
/ v i = Ks / V[S] + (1 / V) (1 + [I] / K I)
pagsugpo sa substrate
Ang pagsugpo sa substrate ay ang pagsugpo ng isang reaksyong enzymatic na sanhi ng labis na substrate. Ang ganitong pagsugpo ay nangyayari dahil sa pagbuo ng isang enzyme-substrate complex na hindi kayang sumailalim sa mga catalytic transformation. Ang ES 2 complex ay hindi produktibo at ginagawang hindi aktibo ang molekula ng enzyme. Ang pagsugpo sa substrate ay sanhi ng labis na substrate, samakatuwid, ito ay tinanggal kapag bumababa ang konsentrasyon nito.
Allosteric inhibition
Ang allosteric regulation ay katangian lamang para sa isang espesyal na grupo ng mga enzyme na may quaternary na istraktura, na may mga sentro ng regulasyon para sa mga nagbubuklod na allosteric effector. Ang mga negatibong effector na pumipigil sa conversion ng substrate sa aktibong site ng enzyme ay kumikilos bilang allosteric inhibitors. Ang mga positibong allosteric effector, sa kabaligtaran, ay nagpapabilis sa reaksyon ng enzymatic, at samakatuwid ay tinutukoy sila bilang mga allosteric activator. Ang mga allosteric effector ng mga enzyme ay kadalasang iba't ibang metabolite, pati na rin ang mga hormone, metal ions, at coenzymes. Sa mga bihirang kaso, ang mga molekula ng substrate ay gumaganap ng papel ng isang allosteric effector ng mga enzyme.
Ang mekanismo ng pagkilos ng allosteric inhibitors sa enzyme ay upang baguhin ang conformation ng aktibong site. Ang pagbaba sa rate ng reaksyon ng enzymatic ay alinman sa isang kinahinatnan ng isang pagtaas sa K m o isang pagbaba sa maximum na rate ng V max sa parehong mga saturating na konsentrasyon ng substrate, i.e. ang enzyme ay bahagyang idle.
Ang mga allosteric enzyme ay naiiba sa iba pang mga enzyme sa kanilang partikular na hugis-S na curve ng rate ng reaksyon kumpara sa konsentrasyon ng substrate. Ang curve na ito ay katulad ng oxygen saturation curve ng hemoglobin; ito ay nagpapahiwatig na ang mga aktibong sentro ng mga subunit ay hindi gumagana nang autonomously, ngunit cooperatively, i.e. ang pagkakaugnay ng bawat susunod na aktibong sentro para sa substrate ay tinutukoy ng antas ng saturation ng mga nakaraang sentro. Ang pinag-ugnay na gawain ng mga sentro ay tinutukoy ng mga allosteric effector.
Ang allosteric regulation ay nagpapakita ng sarili sa anyo ng pagsugpo ng end product ng unang enzyme sa chain. Ang istraktura ng pangwakas na produkto pagkatapos ng isang serye ng mga pagbabagong-anyo ng panimulang sangkap (substrate) ay hindi katulad ng substrate, kaya ang pangwakas na produkto ay maaaring kumilos sa paunang enzyme ng kadena lamang bilang isang allosteric inhibitor (effector). Sa panlabas, ang naturang regulasyon ay katulad ng regulasyon ng mekanismo ng feedback at nagpapahintulot sa iyo na kontrolin ang output ng panghuling produkto, kung sakaling magkaroon ng akumulasyon kung saan huminto ang gawain ng unang enzyme sa chain. Halimbawa, ang aspartate carbamoyltransferase (ACTase) ay nag-catalyze sa una sa anim na reaksyon sa synthesis ng cytidine triphosphate (CTP). Ang CTP ay isang allosteric AKTase inhibitor. Samakatuwid, kapag ang CTP ay nag-iipon, ang AKTase inhibition ay nangyayari at ang karagdagang CTP synthesis ay hihinto. Natuklasan ang allosteric regulation ng mga enzyme sa tulong ng mga hormone. Halimbawa, ang mga estrogen ay isang allosteric inhibitor ng enzyme glutamate dehydrogenase, na nag-catalyze sa deamination ng glutamic acid.
Kaya, kahit na ang pinakasimpleng equation ng kinetic para sa isang reaksyong enzymatic ay naglalaman ng ilang mga parameter ng kinetic, na ang bawat isa ay nakasalalay sa temperatura at kapaligiran kung saan nagaganap ang reaksyon.
Ang mga inhibitor ay ginagawang posible hindi lamang upang maunawaan ang kakanyahan ng enzymatic catalysis, ngunit ito rin ay isang uri ng tool para sa pag-aaral ng papel ng mga indibidwal na reaksyon ng kemikal, na maaaring partikular na isara sa tulong ng isang inhibitor ng isang ibinigay na enzyme.
3. Ang ilang mga aparato ay kapaki-pakinabang para sa pagtukoy ng mga paunang rate ng reaksyon
Maraming mga problema ng enzymatic kinetics ang humahantong sa pagpapasiya ng mga paunang rate ng reaksyon (v 0). Ang pangunahing bentahe ng pamamaraang ito ay ang mga halaga ng v0 na tinutukoy sa paunang sandali ng oras ay magbibigay ng pinakatumpak na representasyon ng aktibidad ng mga enzyme na pinag-aaralan, dahil ang mga naiipon na mga produkto ng reaksyon ay wala pang oras upang magsagawa ng isang nagbabawal na epekto. sa enzyme at, bilang karagdagan, ang reacting system ay nasa isang estado ng nakatigil na ekwilibriyo. .
Sa laboratory practice, gayunpaman, kapag gumagamit ng conventional spectrophotometric, titrimetric, o iba pang mga diskarte para sa pagtatala ng pag-usad ng naturang mga reaksyon, sa pinakamainam, hanggang sa 15-20 segundo mula sa unang oras para sa pagpapasok ng enzyme sa substrate, paghahalo ng reacting system, ang pag-set up ng cell, atbp. ay nawala. At ito ay hindi katanggap-tanggap, dahil sa kasong ito ang padaplis ay dinadala sa punto kung saan tg ά 2< tg ά 1 . Не компенсируется потеря начального времени и при математической обработке таких кривых при записи выхода v 0 на максимальный уровень (V). Кроме того, протекание реакций без Ang patuloy na paghahalo ay mas kumplikado sa pamamagitan ng pagbabagu-bago sa mga konsentrasyon ng mga reagents sa dami.
Ang mga simpleng device na iminungkahi sa ibaba para sa isang spectrophotometer, isang pH meter, at mga katulad nito ay ginagawang posible na makabuluhang bawasan ang mga pinagmumulan ng mga ipinahiwatig na mga error sa pagtukoy ng v 0.
3.1 Device sa spectrophotometer
Ang device para sa spectrophotometer ay binubuo ng isang dispenser 1, isang umiikot na Teflon thread 2 (isang stirrer) at isang fixing cap 3.
Ang dispenser ay isang micropipette, ang isang dulo nito ay nabuo gamit ang isang karayom 4, ang isa pa - na may isang widening 5 (upang maiwasan ang enzyme mula sa pagpasok ng goma tip 6).
Ang Teflon cover 3 na sumasaklaw sa spectral cuvette 7 ay may dalawang butas: isa (8) sa gitna ng takip, ang pangalawa (9) sa itaas ng gitna ng puwang sa pagitan ng opaque na pader ng cuvette 7 at ng light beam 10. Teflon tube 11 (inner diameter 1 -1.5 mm) ay naayos sa isang dulo sa butas 9, ang iba pa - sa isang nakapirming ledge 12 sa harap ng motor rotor 13. Ang Teflon thread 2 ay ipinasok sa loob ng tube (thread kapal 0.5-0.6 mm ). Ang isang dulo ng thread ay naayos sa umiikot na rotor ng motor 13, ang pangalawa - naipasa sa cuvette 7 - ay hugis sa anyo ng isang spiral (upang mapahusay ang paghahalo). Ang posisyon ng thread ay tinutukoy ng pag-aayos ng cap 3, anuman ang distansya ng motor, na maginhawa kapag nagtatrabaho na nangangailangan ng madalas na pagbabago ng mga cuvettes.
Prinsipyo ng operasyon. Ang quartz cuvette ng spectrophotometer 7 ay puno ng substrate 14 (mga 1.5-2.0 ml), na ipinasok sa thermostatic cuvette holder ng spectrophotometer, sarado na may takip 3 na may umiikot na Teflon thread 2, na nahuhulog sa substrate 14, at lahat ng karagdagang operasyon ay ginagawa na sa sinag ng liwanag ng spectrophotometer at naitala sa recorder.
Sa simula ng trabaho, ang substrate ay halo-halong, at ang panulat ng recorder ay nagsusulat ng isang patag na pahalang (o "zero") na linya. Ang dispenser (na may enzyme) ay ipinasok sa butas 8 (ang karayom ay nahuhulog sa substrate solution 14), sa pamamagitan ng mabilis na pagpiga sa tip 6, ang enzyme (karaniwan ay mga 0.03-0.05 ml) ay ipinakilala sa substrate, at ang dispenser ay tinanggal. Ang paghahalo ng mga bahagi ay nagtatapos sa 2.5-3 s, at inaayos ng panulat ng recorder ang simula ng reaksyon sa pamamagitan ng paglihis ng curve ng optical density (ΔA) kumpara sa oras.
Ginagawang posible rin ng naturang device na kumuha ng mga sample mula sa reacting system para sa pagsusuri; magdagdag ng mga inhibitor at activator sa system; baguhin ang mga kondisyon ng reaksyon (baguhin ang pH, lakas ng ionic, atbp.) nang hindi nakakagambala sa pagpaparehistro ng kurso ng reaksyon, na napaka-maginhawa, halimbawa, kapag pinag-aaralan ang paghahati n-NFF "acidic" phosphatases, kung saan cleavage n-NFF ay isinasagawa sa pH 5.0 (o pH 6-7), at ang aktibidad ng mga enzyme ay tinutukoy ng akumulasyon n-nitrophenolate ions sa pH 9.5-10.0.
Ang ganitong aparato ay maginhawa din para sa pagsasagawa ng spectrophotometric titration ng mga enzyme, atbp.
3.2 Device para sa pH meter
Ang device para sa pH meter ay binubuo ng isang binagong dulo ng flow electrode 1, isang semi-microcell 2, isang dispenser 3, at isang electronic circuit para sa pagkonekta ng pH meter sa recorder. Bilang karagdagan, ang device ay may kasamang standard pH meter electrode (4), isang cell holder cover (5), isang thermostatic flow chamber (6), isang substrate solution (7), isang passive magnet (8), at isang active magnet ( 9).
Ang karaniwang dulo ng flow electrode ng pH meter (LPU-01) ay pinalitan ng isang Teflon tube 1 (inner diameter 1.3-1.5 mm), na puno ng asbestos thread, pre-treated na may saturated KCl solution. Ang density ng pagpuno ng thread ay kinokontrol upang ang daloy ng rate ng KCl solusyon sa pamamagitan ng tubo ay malapit sa daloy rate ng orihinal na hindi binagong elektrod. Ang pagpapalit ng tip na ito ay ginagawang posible na bawasan ang laki ng orihinal na gumaganang cell mula 20-25 hanggang 2 ml, na ginagawang posible na pamahalaan nang may kaunting mga volume (1.5 ml) ng mga solusyon ng mga mamahaling biochemical na paghahanda.
Ang electronic circuit para sa pagkonekta ng pH meter (LPU-01) sa recorder ay binubuo ng power source (DC battery 12 V), isang variable wire resistance R 1 (10 - 100 Ohm), na nagtatakda ng boltahe na 9 V sa D809 zener diode ayon sa pagbabasa ng voltmeter, isang variable wire resistance R 2 (15-150 Ohm), na kinokontrol ang setting ng "zero" (reference point) ng pH meter readings sa sukat ng recorder, at variable wire paglaban R 3 (35-500 Ohm), na kinokontrol ang sukat ng pagpapalawak (amplification) ng mga pagbabasa ng pH scale - mga metro sa recorder. Ang circuit ay gumagana nang mapagkakatiwalaan hanggang ang pinagmulan ng boltahe ay bumaba sa ibaba 9 V.
Prinsipyo ng operasyon. Ang 1.5 ml ng substrate ay ipinakilala sa cell (isang glass cylinder na 1.7x2.4 cm), at ang cell ay naayos sa fixing cap 5. Ang pagpapakilos 9 ay naka-on, at ang panulat ng recorder ay nagsusulat ng isang pantay (pangunahing) linya ng sanggunian. Sa tulong ng isang dispenser, 0.03 ml ng enzyme solution ang ipinapasok sa substrate, at inaayos ng pen ng recorder ang simula ng reaksyon sa pamamagitan ng paglihis ng curve ng pH laban sa oras (t).
Ang nasabing aparato ay hindi pinapalitan ang isang pH stat, ngunit isinasaalang-alang ang posibilidad ng pagpapalawak ng sukat ng pH meter, pinapayagan ka nitong mapagkakatiwalaan na magtala ng mga menor de edad na pagbabago sa pH 0.004-0.005.
3.3 Nomogram rulers, maginhawa para sa pagtukoy ng paunang bilis
Ang malaking kumplikado ng pagtukoy ng paunang bilis sa paraan ng mga tangent ay ang pagkalkula ng mga ratio ng mga pagbabago sa mga konsentrasyon ng mga reagents (Δ[S]) bawat yunit ng oras (Δt), i.e. expression v 0 sa M/min mula sa mga kondisyon na
v 0 = lim Δ[S] / Δt, at, t 0.
Sa pagsasagawa, ang ganitong pamamaraan ay karaniwang binubuo ng tatlo o apat na magkakahiwalay na operasyon: ang isang tangent ay iginuhit sa paunang seksyon ng curve ng reaksyon, pagkatapos ay ang bilang ng mga yunit ng nakarehistrong halaga (optical density, anggulo ng pag-ikot, atbp.) bawat isang tiyak ang agwat ng oras ay binibilang, at ito ay humahantong sa yunit ng oras at, sa wakas, muling kalkulahin ang mga pagbasa ng recorder para sa pagbabago sa konsentrasyon ng reagent sa loob ng 1 min (M/min). Ginagawang posible ng iminungkahing dalawang uri ng nomogram ruler na gawing simple ang pamamaraang ito.
Parihabang ruler. Ang v 0 ay ang ratio Δ[S]/Δt, ibig sabihin. tg ά, kung saan ang ά ay ang anggulo ng pagkahilig ng padaplis sa time axis t. Ang parehong tangent ay din ang hypotenuse ng kaukulang kanang tatsulok na may mga binti [S] at t. Ang mas malaking v 0 , mas matarik ang slope ng padaplis. Samakatuwid, kung nililimitahan natin ang ating sarili sa isang tiyak na agwat ng oras, halimbawa 1 min, makakakuha tayo ng isang serye ng mga right-angled na tatsulok na may iba't ibang mga halaga ng binti [S] (sa totoo lang, magkakaibang mga halaga ng v 0) . Kung, gayunpaman, ang parehong mga binti ay nagtapos: pahalang - sa mga yunit ng sanggunian ng oras (1 min), at patayo - sa mga yunit ng pagbabago sa mga konsentrasyon ng reagent, halimbawa, sa millimoles (mM), at ilapat ang mga resultang mga segment sa isang angkop na format mula sa isang transparent na materyal (plexiglass na halos 2 mm ang kapal) , pagkatapos ay makakakuha ka ng isang maginhawang ruler para sa pagtukoy ng mga paunang rate ng reaksyon. Ang lahat ng mga numero at linya ay naka-print sa reverse side ng ruler upang maalis ang parallax error kapag tinutukoy ang v 0.
Ang pamamaraan para sa pagtukoy ng v 0 ay binabawasan sa kasong ito sa dalawang simpleng operasyon: ang isang tangent ay iguguhit sa paunang seksyon ng kinetic curve t 2 at pagsamahin ang zero point ng horizontal leg t ng ruler sa simula ng tangent, ang pagpapatuloy ng tangent ay tatawid na ngayon sa concentration scale [S] sa puntong tumutukoy sa halaga ng v 0 sa M/min (kapag ang leg t ay pahalang, walang karagdagang operasyon ang kinakailangan.
Linya ng arko. Ang pamamaraan para sa pagtukoy ng v 0 ay maaaring gawing simple sa isang operasyon kung ang sukat ng konsentrasyon ay naka-plot sa isang arko ng isang tiyak na radius.
Ang isang tuwid ("basic") na linya 2 ay inilalapat sa isang plato ng transparent na materyal (lahat ng mga numero at linya ay inilalapat din sa reverse side ng ruler) at mula sa zero point (t=0, min) ng linyang ito na may isang radius na katumbas ng haba ng binti t=1 min [ , gumuhit ng arc [S], mula sa itaas hanggang sa ibaba kung saan inilalagay ang sukat ng mga pagbabago sa mga konsentrasyon ng reagent (halimbawa, substrate sa mM).
Ang inilarawan na mga uri ng mga ruler, isang aparato para sa isang spectrophotometer at isang pH meter ay ginamit sa loob ng ilang taon upang matukoy ang mga unang rate ng reaksyon (v 0), sa pag-aaral ng pagtitiyak ng substrate ng mga enzyme, para sa spectrophotometric titration, atbp.
Konklusyon
Sa papel na ito, ang isang seksyon ng enzymology ay isinasaalang-alang na pinag-aaralan ang pag-asa ng rate ng mga reaksiyong kemikal na na-catalyze ng mga enzyme sa isang bilang ng mga kadahilanan sa kapaligiran. Ang mga tagapagtatag ng agham na ito ay itinuturing na sina Michaelis at Menten, na naglathala ng kanilang teorya ng pangkalahatang mekanismo mga reaksyong enzymatic, nagmula sa isang equation na naging pangunahing prinsipyo ng lahat ng kinetic na pag-aaral ng mga enzyme, ito ay nagsisilbing panimulang punto para sa anumang quantitative na paglalarawan ng pagkilos ng mga enzyme. Ang orihinal na Michaelis-Menten equation ay isang hyperbolic equation; Nag-ambag ang Lineweaver at Burke sa kinetics sa pamamagitan ng pagbabago ng Michaelis-Menten equation at pagkuha ng graph ng isang tuwid na linya kung saan ang halaga ng V max ay maaaring mas tumpak na matukoy.
Sa paglipas ng panahon, ang pagbabago sa rate ng reaksyon ng enzymatic sa reaksyon ng enzymatic sa ilalim ng mga eksperimentong kondisyon ay bumababa. Ang pagbaba sa rate ay maaaring mangyari dahil sa isang bilang ng mga kadahilanan: isang pagbawas sa konsentrasyon ng substrate, isang pagtaas sa konsentrasyon ng isang produkto na maaaring magkaroon ng isang pagbawalan na epekto, mga pagbabago sa pH ng solusyon, at mga pagbabago sa temperatura ng daluyan ay maaaring mangyari. Kaya, sa bawat 10°C na pagtaas ng temperatura, ang rate ng reaksyon ay dumoble o mas mababa pa. Ang mababang temperatura ay nababaligtad na hindi aktibo ang mga enzyme. Ang pag-asa ng rate ng reaksyon ng enzymatic sa pH ay nagpapahiwatig ng estado ng mga functional na grupo ng aktibong sentro ng enzyme. Magkaiba ang reaksyon ng bawat enzyme sa mga pagbabago sa pH. Ang mga reaksiyong kemikal ay maaaring ihinto sa pamamagitan ng pagkilos sa kanila na may iba't ibang uri ng pagsugpo. Ang paunang rate ng reaksyon ay maaaring mabilis at tumpak na matukoy sa tulong ng mga kagamitang tulad ng mga nomogram ruler, isang spectrophotometer device at isang pH meter. Pinapayagan nito ang pinakatumpak na representasyon ng aktibidad ng pinag-aralan na mga enzyme.
Ang lahat ng ito ay aktibong ginagamit ngayon sa medikal na kasanayan.
Listahan ng mga mapagkukunang ginamit
1. Belyasova N.A. Biochemistry at molecular biology. - Minsk: book house, 2004. - 416 p., may sakit.
Keleti T. Mga Batayan ng enzymatic kinetics: Per. mula sa Ingles. - M.: Mir, 1990. -350 p., may sakit.
3. Knorre D.G. Biyolohikal na kimika: Proc. para sa kemikal, biol. at pulot. espesyalista. mga unibersidad. - 3rd ed., Rev. - M.: Mas mataas. paaralan 2002. - 479 p.: may sakit.
4. Krupyanenko V.I. Paraan ng vector para sa kumakatawan sa mga reaksyong enzymatic. - M.: Nauka, 1990. - 144 p.
5. Lehninger A. Biochemistry. Molecular base ng istraktura at pag-andar ng cell: Per. mula sa Ingles. - M.: Mir, 1974.
6. Stroev E.A. Biological Chemistry: Isang Textbook para sa Parmasya. in-tov at parmasyutiko. peke. honey. kasama. - M.: Mas mataas na paaralan, 1986. - 479 p., may sakit.
Severin E.S. Biochemistry. a. - 5th ed. - M.: GEOTAR - Media, 2009. - 786 p., may sakit.
Pinag-aaralan ng seksyong ito ng enzymology ang impluwensya ng iba't ibang salik sa bilis ng isang reaksyong enzymatic. Isinasaalang-alang ang pangkalahatang equation ng enzymatic catalysis ng reversible reaction ng pagbabago ng isang substrate sa isang produkto (1),
dapat pangalanan ang mga pangunahing salik na nakakaimpluwensya sa bilis ng isang reaksyong enzymatic: konsentrasyon ng substrate [S], konsentrasyon ng enzyme [E], at konsentrasyon ng produkto ng reaksyon [P].
Ang pakikipag-ugnayan ng ilang mga enzyme sa kanilang substrate ay maaaring ilarawan sa pamamagitan ng hyperbolic curve ng pag-asa ng enzymatic reaction rate V sa konsentrasyon ng substrate [S] (Fig. 19):

Fig. 19. Pag-asa ng rate ng reaksyon ng enzymatic sa konsentrasyon ng substrate.
Tatlong mga segment ang maaaring makilala sa curve na ito, na maaaring ipaliwanag sa pamamagitan ng mga posisyon ng mekanismo ng pakikipag-ugnayan ng enzyme sa substrate: Ang OA ay ang segment ng direktang proporsyonal na pag-asa ng V sa [S], ang mga aktibong site ng enzyme. ay unti-unting napuno ng mga molekula ng substrate na may pagbuo ng isang hindi matatag na kumplikadong ES; seksyon AB - curvilinear dependence ng V sa [S], ang kumpletong saturation ng mga aktibong sentro ng enzyme na may mga substrate molecule ay hindi pa nakakamit. Ang ES complex bago maabot ang transition state ay hindi matatag, ang posibilidad ng back dissociation sa E at S ay mataas pa rin; seksyon BC - dependence ay inilarawan sa pamamagitan ng isang zero-order equation, ang seksyon ay parallel sa [S] axis, kumpletong saturation ng mga aktibong enzymes na may substrate molecules ay nakakamit, V=V max.
Ang katangiang hugis ng kurba ay inilarawan sa matematika ng Briggs-Haldane equation:
V=V max ● [S]/ Km + [S] (2),
kung saan ang Km ay ang Michaelis-Menten constant, ayon sa bilang na katumbas ng konsentrasyon ng substrate kung saan ang rate ng reaksyong enzymatic ay katumbas ng kalahating V max.
Kung mas mababa ang K m ng enzyme, mas mataas ang affinity ng enzyme para sa substrate, mas mabilis na maabot ang estado ng paglipat para sa substrate, at ito ay nagiging isang produkto ng reaksyon. Ang paghahanap para sa mga halaga ng Km para sa bawat substrate ng enzyme na may partikular na grupo ay mahalaga sa pagtukoy ng biological na papel ng enzyme na ito sa cell.
Para sa karamihan ng mga enzyme, imposibleng bumuo ng hyperbolic curve (Larawan 19) Sa kasong ito, ang double reciprocal na paraan (Lineweaver-Burk) ay ginagamit, i.e. naka-plot ang isang graphical na dependence na 1/[V] sa 1/[S] (Larawan 20). Ang paraan ng pagbuo ng gayong mga kurba sa isang eksperimento ay napaka-maginhawa kapag pinag-aaralan ang epekto ng iba't ibang uri ng mga inhibitor sa aktibidad ng mga enzyme (tingnan ang teksto sa ibaba).

Fig.20. Plot ng 1/[V] laban sa 1/[S] (Lineweaver-Burk method),
kung saan ang y-cut-off area - , at x – cut-off area -  , ang padaplis ng anggulo α - .
, ang padaplis ng anggulo α - .
Ang pag-asa ng enzymatic reaction rate V sa konsentrasyon ng enzyme [E].
Ang graphical na pagdepende na ito (Larawan 21) ay isinasaalang-alang sa pinakamabuting kalagayan na temperatura at pH ng kapaligiran, sa mga konsentrasyon ng substrate na makabuluhang mas mataas kaysa sa saturation na konsentrasyon ng mga aktibong site ng enzyme.

kanin. 21. Impluwensya ng konsentrasyon ng enzyme sa rate ng reaksyon ng enzymatic.
Ang pag-asa ng rate ng reaksyon ng enzymatic sa konsentrasyon ng cofactor o coenzyme. Para sa mga kumplikadong enzyme, dapat tandaan na ang kakulangan ng mga coenzyme form ng bitamina sa hypovitaminosis, isang paglabag sa paggamit ng mga metal ions sa katawan ay kinakailangang humantong sa isang pagbawas sa konsentrasyon ng kaukulang mga enzyme na kinakailangan para sa kurso ng metabolic. mga proseso. Samakatuwid, dapat itong tapusin na ang aktibidad ng enzyme ay direktang nakasalalay sa konsentrasyon ng cofactor o coenzyme.
Impluwensya ng konsentrasyon ng mga produkto sa rate ng reaksyon ng enzymatic. Para sa mga nababaligtad na reaksyon na nagaganap sa katawan ng tao, dapat itong isaalang-alang na ang mga produkto ng direktang reaksyon ay maaaring gamitin ng enzyme bilang mga substrate para sa reverse reaction. Samakatuwid, ang direksyon ng daloy at ang sandali ng pag-abot sa V max ay nakasalalay sa ratio ng mga konsentrasyon ng mga paunang substrate at mga produkto ng reaksyon. Halimbawa, ang aktibidad ng alanine aminotransferase, na nagpapagana sa pagbabagong-anyo:
Alanine + Alpha-ketoglutarate ↔ Pyruvate + Glutamate
depende sa cell sa ratio ng mga konsentrasyon:
[alanine + alpha-ketoglutarate] / [pyruvate + glutamate].
MECHANISM OF ENZYME ACTION. MGA TEORYA NG ENZYMATIVE CATALYSIS
Ang mga enzyme, tulad ng mga non-protein catalyst, ay nagpapataas ng rate ng isang kemikal na reaksyon dahil sa kanilang kakayahang babaan ang activation energy ng reaksyong iyon. Ang activation energy ng isang enzymatic reaction ay kinakalkula bilang ang pagkakaiba sa pagitan ng energy value sa system ng patuloy na reaksyon na umabot sa transition state at ang energy na tinutukoy sa simula ng reaction (tingnan ang graphic dependence sa Fig. 22).

kanin. 22. Graphical na pag-asa ng estado ng enerhiya ng isang kemikal na reaksyon na walang enzyme (1) at sa pagkakaroon ng isang enzyme (2) sa oras ng reaksyon.
Ang mga gawa ni V. Henry at, sa partikular, L. Michaelis, M. Menten sa pag-aaral ng mekanismo ng monosubstrate reversible enzymatic reactions ay naging posible na mag-postulate na ang enzyme E ay unang nababaligtad at medyo mabilis na pinagsama sa substrate nito na S upang mabuo. isang enzyme-substrate complex (ES):
E+S<=>ES (1)
Ang pagbuo ng ES ay nangyayari dahil sa mga bono ng hydrogen, electrostatic, hydrophobic na pakikipag-ugnayan, sa ilang mga kaso covalent, mga bono ng koordinasyon sa pagitan ng mga side radical ng mga residue ng amino acid ng aktibong sentro at ang mga functional na grupo ng substrate. Sa kumplikadong mga enzyme, ang hindi protina na bahagi ng istraktura ay maaari ring gumanap ng pag-andar ng pakikipag-ugnay sa substrate.
Ang enzyme-substrate complex pagkatapos ay nasira sa pangalawang mas mabagal na reversible reaction upang mabuo ang reaksyong produkto P at ang libreng enzyme E:
ES<=>EP<=>E + P (2)
Sa kasalukuyan, salamat sa gawain ng mga nabanggit na siyentipiko, pati na rin kay Kaylin D., Chance B., Koshland D. (ang teorya ng "induced conformity"), mayroong mga teoretikal na probisyon sa apat na pangunahing punto sa mekanismo ng pagkilos ng enzyme sa substrate, na tumutukoy sa kakayahan ng mga enzyme na mapabilis ang mga reaksiyong kemikal.
1. Oryentasyon at kalapitan . Nagagawa ng enzyme na magbigkis sa molekula ng substrate sa paraang ang bono na inaatake ng enzyme ay hindi lamang matatagpuan sa kalapit na pangkat ng catalytic, ngunit tama rin na nakatuon sa paggalang dito. Ang posibilidad na maabot ng ES complex ang estado ng paglipat dahil sa oryentasyon at diskarte ay lubhang nadagdagan.
2. Stress at strain : induced fit. Ang pag-attach ng isang substrate ay maaaring maging sanhi ng mga pagbabago sa conformational sa molekula ng enzyme, na humahantong sa pag-igting sa istraktura ng aktibong site, at medyo deform din ang nakagapos na substrate, sa gayon pinapadali ang pagkamit ng estado ng paglipat ng ES complex. Mayroong tinatawag na sapilitan na pagsusulatan sa pagitan ng mga molekula ng E at S.
Pinag-aaralan ng enzymatic kinetics ang rate ng mga reaksyon na na-catalyze ng mga enzyme depende sa iba't ibang kondisyon (konsentrasyon, temperatura, pH, atbp.) ng kanilang pakikipag-ugnayan sa substrate.
Gayunpaman, ang mga enzyme ay mga protina na sensitibo sa impluwensya ng iba't ibang panlabas na impluwensya. Samakatuwid, kapag pinag-aaralan ang rate ng mga reaksyon ng enzymatic, higit sa lahat ang mga konsentrasyon ng mga reactant ay isinasaalang-alang, at ang impluwensya ng temperatura, pH ng daluyan, mga activator, inhibitor, at iba pang mga kadahilanan ay sinubukan na mabawasan at ang mga karaniwang kondisyon ay nilikha. Una, ito ang pinakamainam na halaga ng pH ng daluyan para sa enzyme na ito. Pangalawa, inirerekomenda na panatilihin ang temperatura sa 25°C, kung posible. Pangatlo, ang kumpletong saturation ng enzyme na may substrate ay nakakamit. Ang puntong ito ay lalong mahalaga, dahil sa isang mababang konsentrasyon ng substrate, hindi lahat ng mga molekula ng enzyme ay nakikilahok sa reaksyon (Larawan 6.5, a), na nangangahulugan na ang resulta ay malayo sa pinakamataas na posible. Ang pinakamataas na kapangyarihan ng catalyzed na reaksyon, ang iba pang mga bagay ay pantay, ay nakakamit kung ang bawat molekula ng enzyme ay kasangkot sa pagbabagong-anyo, i.e. sa isang mataas na konsentrasyon ng enzyme-substrate complex (Larawan 6.5, v). Kung ang konsentrasyon ng substrate ay hindi matiyak ang kumpletong saturation ng enzyme (Larawan 6.5, b), kung gayon ang rate ng nagpapatuloy na reaksyon ay hindi umabot sa pinakamataas na halaga.
kanin. 65.
a- sa mababang konsentrasyon ng substrate; 6 - na may hindi sapat na konsentrasyon ng substrate; v - kapag ang enzyme ay ganap na puspos ng substrate
Ang rate ng isang reaksyon ng enzymatic, na sinusukat sa ilalim ng mga kondisyon sa itaas, at ang kumpletong saturation ng enzyme na may substrate ay tinatawag maximum na rate ng reaksyon ng enzymatic (V).
Ang rate ng reaksyon ng enzymatic, na tinutukoy kapag ang enzyme ay hindi ganap na puspos ng substrate, ay tinutukoy v.
Ang enzymatic catalysis ay maaaring simpleng inilarawan ng scheme

kung saan ang F ay isang enzyme; S - substrate; FS - enzyme-substrate complex.
Ang bawat yugto ng prosesong ito ay nailalarawan sa pamamagitan ng isang tiyak na bilis. Ang yunit para sa pagsukat ng rate ng isang reaksyong enzymatic ay ang bilang ng mga moles ng substrate na na-convert sa isang yunit ng oras(tulad ng rate ng isang normal na reaksyon).
Ang pakikipag-ugnayan ng enzyme sa substrate ay humahantong sa pagbuo ng isang enzyme-substrate complex, ngunit ang prosesong ito ay nababaligtad. Ang mga rate ng pasulong at baligtad na mga reaksyon ay nakasalalay sa mga konsentrasyon ng mga reactant at inilarawan ng kaukulang mga equation:
Ang equation (6.3) ay may bisa sa equilibrium, dahil ang mga rate ng pasulong at pabalik na reaksyon ay pantay.
Ang pagpapalit ng mga rate ng direktang (6.1) at reverse (6.2) na mga reaksyon sa equation (6.3), makuha natin ang pagkakapantay-pantay:
Ang estado ng ekwilibriyo ay nailalarawan sa pamamagitan ng katumbas ekwilibriyong pare-pareho K p, katumbas ng ratio ng mga constant ng direkta at baligtad na reaksyon (6.5). Ang reciprocal ng equilibrium constant ay tinatawag pare-pareho ang substrate K s , o ang dissociation constant ng enzyme-substrate complex:

Mula sa equation (6.6) ay malinaw na ang substrate constant ay bumababa sa isang mataas na konsentrasyon ng enzyme-substrate complex, i.e. na may mahusay na katatagan. Samakatuwid, ang substrate constant ay nagpapakilala sa affinity ng enzyme at substrate at ang ratio ng mga rate ng constants para sa pagbuo at dissociation ng enzyme-substrate complex.
Ang kababalaghan ng saturation ng isang enzyme na may substrate ay pinag-aralan nina Leonor Michaelis at Maud Mepten. Batay sa pagproseso ng matematika ng mga resulta, nakuha nila ang equation (6.7), na natanggap ang kanilang mga pangalan, kung saan malinaw na sa isang mataas na konsentrasyon ng substrate at isang mababang halaga ng pare-pareho ang substrate, ang rate ng reaksyon ng enzymatic ay may posibilidad. sa maximum. Gayunpaman, ang equation na ito ay limitado dahil hindi nito isinasaalang-alang ang lahat ng mga parameter:
Ang enzyme-substrate complex sa panahon ng reaksyon ay maaaring sumailalim sa mga pagbabago sa iba't ibang direksyon:
- ihiwalay sa orihinal na mga sangkap;
- ma-convert sa isang produkto kung saan ang enzyme ay pinaghihiwalay nang hindi nagbabago.
Samakatuwid, upang ilarawan ang pangkalahatang epekto ng proseso ng enzymatic, ang konsepto Michaelis constants K t, na nagpapahayag ng relasyon ng mga pare-pareho ng rate ng lahat ng tatlong reaksyon ng enzymatic catalysis (6.8). Kung ang parehong mga termino ay nahahati sa rate ng pare-pareho ng reaksyon ng pagbuo ng enzyme-substrate complex, kung gayon ang expression (6.9) ay makukuha:

Isang mahalagang corollary ang sumusunod mula sa equation (6.9): ang Michaelis constant ay palaging mas malaki kaysa sa substrate constant ng k 2 /kv
Bilang numero K t ay katumbas ng naturang konsentrasyon ng substrate kung saan ang rate ng reaksyon ay kalahati ng pinakamataas na posibleng rate at tumutugma sa naturang saturation ng enzyme na may substrate, tulad ng sa Fig. 6.5, b. Dahil sa pagsasagawa, hindi laging posible na makamit ang kumpletong saturation ng enzyme na may substrate, ito ay K t ginagamit upang ihambing ang mga kinetic na katangian ng mga enzyme.
Ang rate ng reaksyon ng enzymatic sa kaso ng hindi kumpletong saturation ng enzyme na may substrate (6.10) ay depende sa konsentrasyon ng enzyme-substrate complex. Ang koepisyent ng proporsyonalidad ay ang pare-parehong reaksyon para sa pagpapalabas ng enzyme at produkto, dahil binabago nito ang konsentrasyon ng enzyme-substrate complex:
Matapos ang mga pagbabagong-anyo, isinasaalang-alang ang mga dependency na ipinakita sa itaas, ang rate ng reaksyon ng enzymatic sa kaso ng hindi kumpletong saturation ng enzyme na may substrate ay inilarawan ng equation (6.11), i.e. depende sa mga konsentrasyon ng enzyme, substrate at ang kanilang pagkakaugnay Ks:
Ang graphical na pag-asa ng rate ng reaksyon ng enzymatic sa konsentrasyon ng substrate ay hindi linear. Gaya ng nakikita mula sa Fig. 6.6, na may pagtaas sa konsentrasyon ng substrate, ang isang pagtaas sa aktibidad ng enzyme ay sinusunod. Gayunpaman, kapag ang maximum na saturation ng enzyme na may substrate ay naabot, ang rate ng enzymatic reaksyon ay nagiging maximum. Samakatuwid, ang kadahilanan na naglilimita sa rate ng reaksyon ay ang pagbuo ng isang enzyme-substrate complex.
Ipinakita ng pagsasanay na ang mga konsentrasyon ng mga substrate, bilang panuntunan, ay ipinahayag sa mga halaga na mas mababa kaysa sa pagkakaisa (10 6 -10 3 mol). Ito ay medyo mahirap na gumana sa mga naturang dami sa mga kalkulasyon. Samakatuwid, iminungkahi ni G. Lineweaver at D. Burke na ipahayag ang graphic na pag-asa ng rate ng reaksyon ng enzymatic hindi sa mga direktang coordinate, ngunit sa mga kabaligtaran. Nagpatuloy sila mula sa pag-aakalang para sa pantay na mga halaga, ang kanilang mga kapalit ay pantay din:

kanin. 6.6.
Pagkatapos ng pagbabagong-anyo ng expression (6.13), isang expression ay nakuha, tinatawag Lineweaver-Burk equation (6.14):
Ang graphical dependence ng Lineweaver-Burk equation ay linear (Fig. 6.7). Ang mga kinetic na katangian ng enzyme ay tinutukoy bilang mga sumusunod:
- ang segment na pinutol sa y-axis ay katumbas ng 1/V;
- ang segment na pinutol sa x-axis ay -1 /K t.

kanin. 6.7.
Ito ay pinaniniwalaan na ang paraan ng Lineweaver - Burke ay nagbibigay-daan sa iyo upang mas tumpak na matukoy ang maximum na rate ng reaksyon kaysa sa mga direktang coordinate. Ang mahalagang impormasyon tungkol sa pagsugpo ng enzyme ay maaari ding makuha mula sa graph na ito.
Mayroong iba pang mga paraan upang baguhin ang Michaelis-Menten equation. Ginagamit ang mga graphic na dependency sa pag-aaral ng impluwensya ng iba't ibang panlabas na impluwensya sa proseso ng enzymatic.